题目内容
16.在一固定体积的密闭容器中,加入2mol A和1mol B发生可逆反应2A(g)+B(g)?3C(g)+D(g),达到平衡,C的浓度为w mol/L.若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,C的浓度仍为w mol/L的是( )| A. | 4 mol A+2 mol B | |
| B. | 1 mol B+3 mol C+1 mol D | |
| C. | 3 mol C+2 mol D | |
| D. | 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D |
分析 A.等效为在原平衡的基础上压强增大一倍到达的平衡状态,与原平衡相比平衡向逆反应方向移动;
B.等效为开始加入2molA+2molB,相当于在原平衡的基础上在加入1molB,与原平衡相比平衡向正反应方向移动;
C.等效为开始加入2molA+1molB+1molD,相当于在原平衡的基础上在加入1molD,与原平衡相比平衡向逆反应方向移动;
D.等效为开始加入2molA+1molB,与原平衡为完全等效平衡.
解答 解:A.等效为在原平衡的基础上压强增大一倍到达的平衡状态,与原平衡相比平衡向逆反应方向移动,C的物质的量减小大于混合气体总物质的量减小,故C的物质的量百分含量降低,故A错误;
B.等效为开始加入2molA+2molB,相当于在原平衡的基础上在加入1molB,平衡向正反应方向移动,故C的物质的量百分含量增大,故B错误;
C.等效为开始加入2molA+1molB+1molD,相当于在原平衡的基础上在加入1molD,与原平衡相比平衡向逆反应方向移动,则C的物质的量百分含量降低,故C错误;
D.等效为开始加入2molA+1molB,与原平衡为完全等效平衡,C的物质的量百分含量不变等于w,故D正确;
故选D.
点评 本题考查等效平衡、化学平衡影响因素等,难度中等,构建平衡建立的途径是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
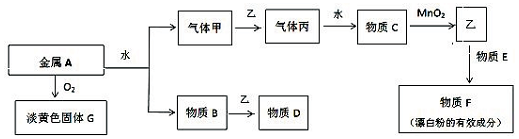
4.研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
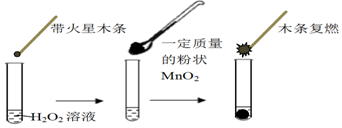
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如表:
由此得出的结论是在一定质量范围内,增加MnO2的质量,化学反应速率加快.
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如表实验(三支试管中均盛有10mL 5% H2O2 ):
结论是Fe3+和Cu2+对H2O2分解均有催化效果,且Fe3+比Cu2+催化效果好,实验Ⅲ的目的是对比实验,说明Cl-对的H2O2分解没有催化效果.
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl═2FeCl3+2H2O.

(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如表:
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如表实验(三支试管中均盛有10mL 5% H2O2 ):
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl═2FeCl3+2H2O.
3. 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
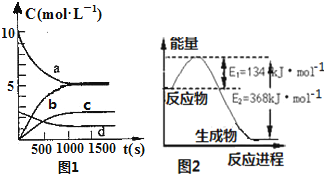
(1)一定温度下,在体积为2L的恒容密闭容器中充入20molNO2和5molO2发生如下反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如图1:
①写出该反应的逆反应的平衡常数表达式:K=$\frac{c{\;}^{2}(N{\;}_{2}O{\;}_{5})}{{c}^{4}(NO{\;}_{2})•c(O{\;}_{2})}$.已知:K300℃>K350℃,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为,若要增大NO2的转化率,可采取的措施有BC.
A.再充入NO2 B.再充入4molNO2和1molO2 C.降低温度 D.充入氦气
③图1中表示N2O5的浓度的变化曲线是c;
(2)图2是1molNO2气体和1molCO气体反应生成CO2气体和NO气体过程中能量变化示意图;又已知:
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-760.3kJ•mol-1,则反应:
N2(g)+2NO2(g)?4NO(g) 的△H=+292.3kJ•mol-1.
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.(1)一定温度下,在体积为2L的恒容密闭容器中充入20molNO2和5molO2发生如下反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如图1:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为,若要增大NO2的转化率,可采取的措施有BC.
A.再充入NO2 B.再充入4molNO2和1molO2 C.降低温度 D.充入氦气
③图1中表示N2O5的浓度的变化曲线是c;
(2)图2是1molNO2气体和1molCO气体反应生成CO2气体和NO气体过程中能量变化示意图;又已知:
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-760.3kJ•mol-1,则反应:
N2(g)+2NO2(g)?4NO(g) 的△H=+292.3kJ•mol-1.
4.下列说法正确的是( )
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | 对于能够自发进行的吸热反应,其原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
 .
.
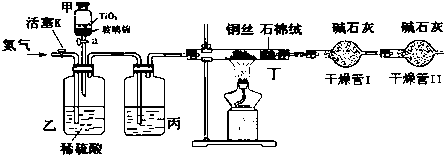
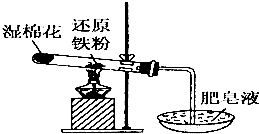 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.