题目内容
 下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,且反应③中有O2产生,回答问题:
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,且反应③中有O2产生,回答问题:(1)A是
(2)写出反应②的离子方程式:
(3)写出反应④的化学反应方程式
考点:无机物的推断
专题:
分析:A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色,则均为钠的单质或化合物,所以A为Na,结合转化关系可知,B为Na2O2,C为NaOH,D为Na2CO3,E为NaHCO3,据此解答.
解答:
解:A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色,则均为钠的单质或化合物,所以A为Na,结合转化关系可知,B为Na2O2,C为NaOH,D为Na2CO3,E为NaHCO3,
(1)由上述分析可知,A是Na,E 是 NaHCO3,故答案为:Na;NaHCO3;
(2)反应②是Na与水反应生成氢氧化钠与氢气,反应离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,
故答案为:2Na+2H2O═2Na++2OH-+H2↑;
(3)反应④是过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应化学方程式为:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2.
(1)由上述分析可知,A是Na,E 是 NaHCO3,故答案为:Na;NaHCO3;
(2)反应②是Na与水反应生成氢氧化钠与氢气,反应离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,
故答案为:2Na+2H2O═2Na++2OH-+H2↑;
(3)反应④是过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应化学方程式为:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2.
点评:本题考查无机物推断,涉及Na元素单质、化合物的性质,根据焰色反应推断单质A为钠,再结合转化关系推断,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,相同物质的量浓度的下列溶液中,pH最小的是( )
| A、KOH |
| B、NH3?H2O |
| C、HCl |
| D、H2SO4 |
硝酸发生氧化还原反应时,硝酸浓度越稀,对应还原产物中氮元素化合价越低,现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐渐加入5mol/LNaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.则下列叙述错误的是( )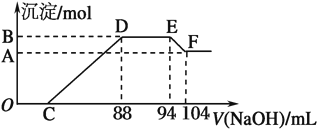

| A、DE段方程式为NH4++OH-=NH3?H2O |
| B、原硝酸溶液中含硝酸的物质的量为0.47 mol |
| C、C点对应的溶液体积为40 mL |
| D、混合物中铝粉与铁粉的物质的量之比为5:3 |
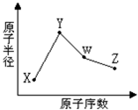 X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
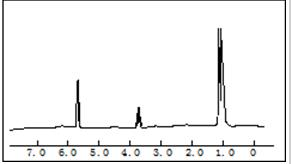 某有机物完全燃烧,只生成二氧化碳和水,元素分析结果为C%=62.1%,H%=10.3%,对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条线,右图是该物质的核磁共振氢谱,并且峰面积比分别为1:2:3,根据上述信息,完成下列问题:
某有机物完全燃烧,只生成二氧化碳和水,元素分析结果为C%=62.1%,H%=10.3%,对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条线,右图是该物质的核磁共振氢谱,并且峰面积比分别为1:2:3,根据上述信息,完成下列问题: