题目内容
下列实验操作不正确的是( )
| A、NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时即停止加热 |
| B、除去Fe(OH)3胶体中混有的Cl-离子,可用渗析的方法 |
| C、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| D、用四氯化碳萃取碘时,碘的四氯化碳溶液从分液漏斗上口倒出 |
考点:物质的分离、提纯和除杂
专题:化学实验基本操作
分析:A.蒸发皿中的溶液不能完全蒸干,当大量晶体析出时,要用余热来蒸干;
B.根据分散质粒子直径大小的不同,可用渗析的方法除去Fe(OH)3胶体中混有的Cl-离子;
C.应使温度计水银球靠近蒸馏烧瓶的支管口处,便于准确测定蒸汽的温度;
D.四氯化碳的密度比水大.
B.根据分散质粒子直径大小的不同,可用渗析的方法除去Fe(OH)3胶体中混有的Cl-离子;
C.应使温度计水银球靠近蒸馏烧瓶的支管口处,便于准确测定蒸汽的温度;
D.四氯化碳的密度比水大.
解答:
解:A.用蒸发方法使NaCl从溶液中析出时,蒸发皿中有大量晶体析出时,停止加热,要用余热来蒸干,故A正确;
B.根据分散质粒子直径大小的不同,除去Fe(OH)3胶体中混有的Cl-离子,可用渗析的方法,故B正确;
C.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处,便于准确测定蒸汽的温度,故C正确;
D.四氯化碳的密度比水大,故四氯化碳萃取碘时,碘的四氯化碳溶液从分液漏斗下口放出,故D错误;
故选D.
B.根据分散质粒子直径大小的不同,除去Fe(OH)3胶体中混有的Cl-离子,可用渗析的方法,故B正确;
C.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处,便于准确测定蒸汽的温度,故C正确;
D.四氯化碳的密度比水大,故四氯化碳萃取碘时,碘的四氯化碳溶液从分液漏斗下口放出,故D错误;
故选D.
点评:本题考查学生物质的分离和提纯的方法,属于综合知识的考查题目,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
相关题目
下列陈述正确的是( )
| A、氢氧化铁胶体稳定存在的主要原因是氢氧化铁胶体带正电荷 |
| B、向BaCl2溶液中通入SO2气体会产生白色沉淀 |
| C、CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| D、CuSO4?5H2O是一种纯净物 |
下列离子方程式正确的是( )
| A、碳酸氢钠水解:HCO3-+H2O?H3O++CO32- |
| B、醋酸铵溶于水:CH3COONH4+H2O?CH3COOH+NH3?H2O |
| C、硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| D、硫酸钙悬浊液中加入碳酸钠:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq) |
下列现象与盐类水解无关的是( )
| A、将Al粉投入到NaHSO4溶液中,有气泡生成 |
| B、配制FeCl3溶液时适当加入少量盐酸 |
| C、明矾可作净水剂 |
| D、泡沫灭火器用Al2(SO4)3与NaHCO3为原料 |
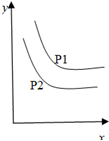 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A、上述反应是放热反应 |
| B、a=b |
| C、a>b |
| D、上述反应是吸热反应 |
某溶液中含有两种溶质AlCl3和H2SO4,它们的物质的量之比为2:1.用石墨做电极电解该混合溶液时,根据电极产物,可分为若干个阶段,下列叙述不正确的是( )
| A、阴极自始至终只有H2 |
| B、阳极先析出Cl2后析出O2 |
| C、电解最后阶段为电解水 |
| D、溶液中先有白色沉淀生成后沉淀全部溶解 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、由水电离的c(H+)=1×10-14 mol?L-1的溶液中:Ca2+、K+、Cl-、CH3COO- | ||
| C、c(Fe3+)=0.1 mol?L-1的溶液中:K+、ClO-、SO42-、SCN- | ||
D、
|