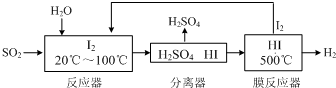
题目内容
1.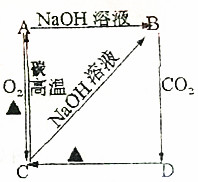 根据如图所示变化关系,请回答下列问题.
根据如图所示变化关系,请回答下列问题.(1)写出A、B、C、D物质的化学式.
A.Si B.Na2SiO3 C.SiO2 D.H2SiO3
(2)写出C→A的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
(3)写出下列变化的离子方程式.
A→B:Si+2OH-+H2O=SiO32-+2H2↑.
C→B:SiO2+2OH-=SiO32-+H2O.
分析 由题给信息以及转化关系可知C为氧化物,且在高温下可与碳反应生成A,A能与氢氧化钠溶液反应,只有Si符合,即A应为Si,则C为SiO2,B为Na2SiO3,D为H2SiO3,结合对应物质的性质解答该题.
解答 解:由题给信息以及转化关系可知C为氧化物,且在高温下可与碳反应生成A,A能与氢氧化钠溶液反应,只有Si符合,即A应为Si,则C为SiO2,B为Na2SiO3,D为H2SiO3,
(1)由以上分析可知A为Si,B为Na2SiO3,C为SiO2,D为H2SiO3,故答案为:Si;Na2SiO3;SiO2;H2SiO3;
(2)C为SiO2,在高温下可与碳反应生成A,反应的方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO;
(3)Si与氢氧化钠反应生成硅酸钠和氢气,反应的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑,二氧化硅与氢氧化钠反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,故答案为:Si+2OH-+H2O=SiO32-+2H2↑;SiO2+2OH-=SiO32-+H2O.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握硅及其化合物的性质以及转化关系,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11. 对于可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时C的百分含量与温度(T)和压强(P)关系如图所示,下面叙述正确的是( )
对于可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时C的百分含量与温度(T)和压强(P)关系如图所示,下面叙述正确的是( )
 对于可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时C的百分含量与温度(T)和压强(P)关系如图所示,下面叙述正确的是( )
对于可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时C的百分含量与温度(T)和压强(P)关系如图所示,下面叙述正确的是( )| A. | 使用催化剂,C的百分含量增大 | |
| B. | 升温,化学平衡向正反应方向移动 | |
| C. | 化学方程式的化学计量数关系m+n>e+f | |
| D. | 该反应是一个放热反应 |
9.25℃时,下列各溶液中有关物质的量浓度关系不正确的是( )
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | Na2CO3溶液中:2c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| C. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO${\;}_{3}^{2-}$) | |
| D. | 常温下,pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3OONa混合液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
13.现有50mL0.1mol•L-1三种一元弱酸,分别用0.1mol•L-1的NaOH溶液滴定,所得滴定曲线如图所示,下列说法正确的是( )
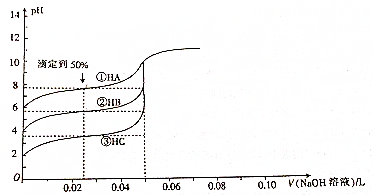

| A. | Ka(HA)>Ka(HB)>Ka(HC) | |
| B. | 滴定到50%时,溶液中:c(A-)>(B-)>(C-) | |
| C. | V(NaOH)溶液=50mL时,溶液中水的电离程度:①>②>③ | |
| D. | V(NaOH)溶液=50mL时,溶液pH的大小关系:pH(A)<pH(B)<pH(C) |
11.A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示.A元素的某种同素原子没有中子,D元素的原子序数是C的2倍,E是短周期主族元素中半径最大的元素.下列说法不正确的是( )
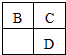

| A. | 简单离子的半径大小关系:B>C>E | |
| B. | D、E两种元素形成的化合物,可能含有离子键和共价键 | |
| C. | B、D分别和C形成的化合物,都有可能使溴水或品红溶液褪色 | |
| D. | A、B、C三种元素形成的化合物,晶体类型一定相同 |