题目内容
12.用一定量的Cu与100mL物质的量浓度为1mol/L的稀硝酸反应,测得反应后溶液的体积为448mL.请计算:(1)需要消耗Cu多少g?被还原的HNO3的物质的量是多少?
(2)若将反应后溶液的体积不变,则此时溶液中NO3-物质的量浓度是多少?
分析 (1)Cu与稀硝酸反应生成气体为NO,根据电子转移守恒计算Cu的物质的量,再根据m=nM计算Cu的质量;
被还原的硝酸生成NO,根据N原子守恒计算被还原硝酸物质的量;
(2)根据N原子守恒计算反应溶液中NO3-物质的量浓度.
解答 解:(1)Cu与稀硝酸反应生成气体为NO,NO物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,根据电子转移守恒,Cu的物质的量为$\frac{0.02mol×3}{2}$=0.03mol,则Cu的质量为0.03mol×64g/mol=1.92g;
被还原的硝酸生成NO,根据N原子守恒,被还原硝酸物质的量为0.02mol,
答:消耗Cu的质量为1.92g被还原硝酸的物质的量为0.02mol.
(2)根据N原子守恒,反应溶液中NO3-物质的量浓度为1mol/L-$\frac{0.02mol}{0.1L}$=0.8mol/L,
答:反应溶液中NO3-物质的量浓度为0.8mol/L.
点评 本题考查氧化还原反应计算、化学方程式计算,注意利用守恒法解答,侧重考查学生分析计算能力.

练习册系列答案
相关题目
2.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3.H2S CO2 | |
| B. | H2O NH3•H2O HClO.HF | |
| C. | H2SO3 Ba(OH)2 BaSO4 | |
| D. | Cu(OH)2 CH3COOH C2H5OH CH3COONa |
3.一定温度下,将浓度为a mol•L-1的Na2S溶液加水不断稀释,下列各量始终保持减小的是( )
| A. | c(OH-) | B. | Kh(Na2S) | C. | $\frac{c({H}^{+})}{c({S}^{2-})}$ | D. | $\frac{c(N{a}^{+})}{c({S}^{2-})}$ |
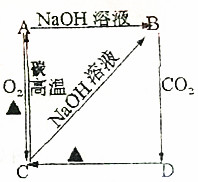
7.如图甲池和乙池中的四个电极都是铂电极,乙池溶液分层,上层溶液为某盐溶液,呈中性.请根据下图所示,判断下列说法正确的是( )


| A. | 甲池是电解池,乙池是原电池;A电极反应式为:C2H5OH+3H2O-12e-═2CO2+12H+ | |
| B. | 反应一段时间后,两池溶液的pH均未变化 | |
| C. | 假如乙池中加入K2SO4溶液,隔膜只允许K+通过,当电路中转移0.01mol e-时,则隔膜左侧溶液中最终减少离子约0.02mol | |
| D. | 假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色 |
 ;
;
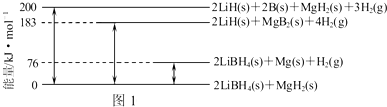
 根据如图所示变化关系,请回答下列问题.
根据如图所示变化关系,请回答下列问题.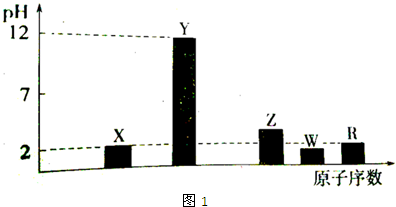
 .
.