题目内容
11. 对于可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时C的百分含量与温度(T)和压强(P)关系如图所示,下面叙述正确的是( )
对于可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时C的百分含量与温度(T)和压强(P)关系如图所示,下面叙述正确的是( )| A. | 使用催化剂,C的百分含量增大 | |
| B. | 升温,化学平衡向正反应方向移动 | |
| C. | 化学方程式的化学计量数关系m+n>e+f | |
| D. | 该反应是一个放热反应 |
分析 T2达到平衡时间短,温度较高,而C%含量低,则正反应方向放热,P2达到平衡时间短,压强较大,而C%含量低,则m+n<e+f,催化剂不影响平衡移动,据此判断.
解答 解:A、催化剂只影响反应速率,不影响平衡移动,故A错误;
B、T2达到平衡时间短,温度较高,而C%含量低,正反应方向放热,升温平衡逆向移动,故B错误;
C、P2达到平衡时间短,压强较大,而C%含量低,则m+n<e+f,故C错误;
D、T2达到平衡时间短,温度较高,而C%含量低,正反应方向放热,故D正确;
故选D.
点评 本题考查化学平衡图象、影响平衡的因素、影响因素等,难度不大,注意掌握平衡移动原理,根据图象判断温度和压强对平衡移动的影响.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
1.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )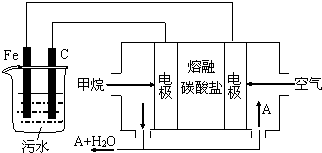

| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |
2.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3.H2S CO2 | |
| B. | H2O NH3•H2O HClO.HF | |
| C. | H2SO3 Ba(OH)2 BaSO4 | |
| D. | Cu(OH)2 CH3COOH C2H5OH CH3COONa |
19.某试剂瓶所装物质经元素分析仪确定仅含有一种元素,则该物质( )
| A. | 一定是单质 | B. | 一定是混合物 | ||
| C. | 可能是单质也可能是化合物 | D. | 可能单质是也可能是混合物 |
16.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA(注:粗铜含有Zn、Fe等杂质) | |
| B. | 含0.2mol H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA | |
| C. | 在标况下,22.4L SO3和22.4L C2H4原子个数比为2:3 | |
| D. | 将78g Na2O2与过量CO2反应,CO2转移的电子数为2NA |
3.一定温度下,将浓度为a mol•L-1的Na2S溶液加水不断稀释,下列各量始终保持减小的是( )
| A. | c(OH-) | B. | Kh(Na2S) | C. | $\frac{c({H}^{+})}{c({S}^{2-})}$ | D. | $\frac{c(N{a}^{+})}{c({S}^{2-})}$ |
 ;
; 根据如图所示变化关系,请回答下列问题.
根据如图所示变化关系,请回答下列问题.