题目内容
12.碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图: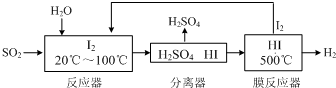
①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+.
②用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M$?_{放电}^{充电}$ NiO(OH)+MH,电池放电时,负极电极反应式为:MH-e-+OH-=H2O+M.
分析 ①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI;
②负极反应物MH失去电子,生成的H+在碱性条件下生成H2O,据此书写.
解答 解:①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI,反应方程式为SO2+I2+2H2O=SO42-+2I-+4H+,故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
②负极反应物MH失去电子,生成的H+在碱性条件下生成H2O,电解反应式为:MH-e-+OH-=H2O+M,
故答案为:MH+OH--e-=M+H2O.
点评 本题是一道开放性的题目,考查了学生流程图和电化学的知识,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列化合物中同分异构体数目(不考虑立体异构)最少的是( )
| A. | 分子式为C5H12的烃 | B. | 分子式为C4H10O的醇 | ||
| C. | 分子式为C4H8的烯烃 | D. | 分子式为C3H6O2的酯 |
4.常温下某溶液中由水电离产生的[H+]=1×10-9mol•L-1,则下列叙述正确的是( )
| A. | PH值一定为5 | B. | 一定是酸溶液 | ||
| C. | 可能是强酸的酸式盐溶液 | D. | PH值可能为9 |
1.下列表示式错误的是( )
| A. | Mg2+的电子排布图: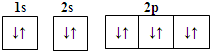 | B. | Na+的结构示意图: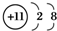 | ||
| C. | Cr的价层电子排布式:3d54s1 | D. | C的电子排布式:1s22s12p3 |
2.常温下,下列各组离子能在指定环境中大量共存的是( )
| A. | pH=13的溶液:SO32-、Na+、Al3+ | |
| B. | 使甲基橙溶液变红色的溶液:Na+、SO42-、CO32- | |
| C. | 在c(H+)=10-12mol/L的溶液:NH4+、Cl-、NO3- | |
| D. | 加入足量Na2O2后的溶液:K+、Cl-、ClO- |
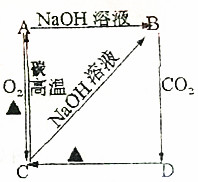 根据如图所示变化关系,请回答下列问题.
根据如图所示变化关系,请回答下列问题.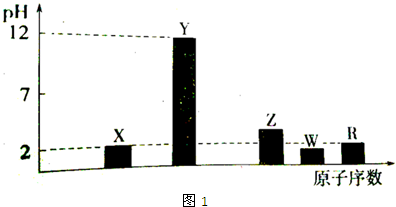
 .
.
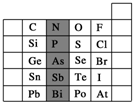 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.