题目内容
17.某化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.下列有关评价正确的是( )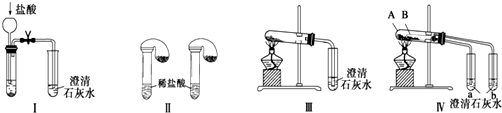
| A. | 根据图Ⅰ所示实验,可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体 | |
| B. | 在图Ⅱ所示实验的左右两只试管中加入足量的盐酸,然后向两个气球中分别加入等物质的量的碳酸钠和碳酸氢钠固体,根据反应后气球的大小可鉴别两种固体 | |
| C. | 与实验Ⅲ相比,实验Ⅳ的突出优点是可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 | |
| D. | 若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠 |
分析 A.碳酸钠和碳酸氢钠固体都能与盐酸反应生成二氧化碳;
B.等物质的量的碳酸钠和碳酸氢钠固体生成二氧化碳的体积相同;
C.IV可以做到一套装置同时进行两个对比实验;
D.不直接加热碳酸氢钠就能分解更说明碳酸氢钠不稳定.
解答 解:A.澄清石灰水变浑浊能说明有二氧化碳生成,碳酸钠和碳酸氢钠固体都能与盐酸反应生成二氧化碳,故A错误;
B.等物质的量的碳酸钠和碳酸氢钠固体生成二氧化碳的体积相同,无法鉴别,故B错误;
C.实验Ⅲ、Ⅳ相比,IV可以做到一套装置同时进行两个对比实验,而III不能,故C正确;
D.碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定,试管B中装入的固体最好是碳酸氢钠,故D错误.
故选C.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、性质差异及反应与现象为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
9.下列物质的分子中,共用电子对数目最多的是( )
| A. | N2 | B. | NH3 | C. | CO2 | D. | CH4 |
8.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
| A. | NaAlO2 和 HCl | B. | MgCl2和 NH3•H2O | C. | Na2CO3和HCl | D. | AlCl3和NaOH |
5.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 500℃左右比室温更有利于合成氨的反应(△H<0) | |
| C. | 红棕色的NO2加压后颜色先变深再变浅(2 NO2?N2O4(无色)) | |
| D. | 光照新制的氯水时,溶液的pH逐渐减小 |
9.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则( )
| A. | 反应过程中得到8.96 L的气体 | B. | 最终得到的溶液中溶质为NaCl | ||
| C. | 最终Al元素全部以沉淀形式存在 | D. | 最终得到的溶液中n(NaCl)=0.3 mol |
6.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1molNa2CO3含有的Na+离子数为2 NA | |
| C. | 通常状况下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 1mol/L的MgCl2溶液中,含有Cl- 个数为2 NA |
7.现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
| A. | 加水稀释成100 mL | B. | 加入10 mL的水进行稀释 | ||
| C. | 加入10 mL 0.01 mol/L的NaOH溶液 | D. | 加入10 mL 0.01 mol/L的HCl溶液 |

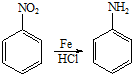
 +2NaOH$→_{一定条件}^{水}$
+2NaOH$→_{一定条件}^{水}$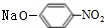 +NaCl+H2O.
+NaCl+H2O.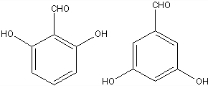 、
、 .
.