题目内容
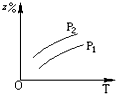
可逆反应mA(g)?nB(g)+pC(s)△H=QKJ/moL,温度和压强的变化对正、逆反应速率的影响分别符合图中的两个图象,以下叙述正确的是( )


| A、m>n,Q>0 |
| B、m<n+p,Q>0 |
| C、m>n,Q<0 |
| D、m>n+p,Q<0 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:由图象可知,升高温度,逆反应速率大于正反应速率,则升高温度,平衡逆向移动;
增大压强,正反应速率大于逆反应速率,则增大压强,平衡正向移动,以此来解答.
增大压强,正反应速率大于逆反应速率,则增大压强,平衡正向移动,以此来解答.
解答:
解:由图象可知,升高温度,逆反应速率大于正反应速率,则升高温度,平衡逆向移动,所以该正反应为放热反应,Q<0;
增大压强,正反应速率大于逆反应速率,则增大压强,平衡正向移动,该反应为气体气体缩小的反应,所以m>n,
故选C.
增大压强,正反应速率大于逆反应速率,则增大压强,平衡正向移动,该反应为气体气体缩小的反应,所以m>n,
故选C.
点评:本题考查反应速率、化学平衡图象,明确交点为平衡点,利用温度、压强对反应速率的影响分析平衡的移动是解答本题的关键,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
常温条件下,下列溶液中的各组离子一定能够大量共存的是( )
| A、pH=1的溶液:Na+、Fe2+、Cl-、NO3- | ||
| B、含有大量I-的溶液:ClO-、Na+、Cl-、CO32- | ||
C、
| ||
| D、加入铝粉能放出大量H2的溶液:K+、NH4+、SO42-、CO32- |
下列实验事实不能说明醋酸是弱电解质的是( )
| A、醋酸溶液的导电性比盐酸弱 |
| B、0.01ml/L醋酸溶液PH>2 |
| C、CH3COONa溶液PH>7 |
| D、将PH=3醋酸溶液稀释100倍,稀释后溶液PH:3<PH<5 |
将CO2通入下列物质的溶液中,不与其反应的是( )
①Na2CO3②Na2SiO3③Na[Al(OH)4]④C6H5ONa ⑤Ca(ClO)2 ⑥CaCl2 ⑦CaCO3?
①Na2CO3②Na2SiO3③Na[Al(OH)4]④C6H5ONa ⑤Ca(ClO)2 ⑥CaCl2 ⑦CaCO3?
| A、①③④⑤⑥ | B、①和⑥ |
| C、只有① | D、只有⑥ |
一定量的盐酸和过量的铁粉反应,为了减缓反应速率,且不影响生成氢气的量,可向盐酸中加入适量的( )
| A、KNO3溶液 |
| B、K2CO3 溶液 |
| C、CuSO4 固体 |
| D、CH3COONa固体 |
下列各原子或离子的电子排布式错误的是( )
| A、K+ 1s22s22p63s23p6 |
| B、As 1s22s22p63s23p64s24p3 |
| C、N3- 1s22s22p6 |
| D、Cr 1s22s22p63s23p63d44s2 |
下列关于电解池的叙述不正确的是( )
| A、在电解池的阴极发生还原反应 |
| B、与电源负极相连的是电解池的阳极 |
| C、阴离子移向电解池的阳极 |
| D、电子从电源的负极沿导线流入电解池的阴极 |
1.4g铁全部溶于盐酸中,加入足量NaOH溶液,得红褐色沉淀,过滤后给红褐色沉淀加热(在空气中),最后得到红色物质的质量是( )
| A、2g | B、1.6g |
| C、1g | D、1.8g |