题目内容
1.4g铁全部溶于盐酸中,加入足量NaOH溶液,得红褐色沉淀,过滤后给红褐色沉淀加热(在空气中),最后得到红色物质的质量是( )
| A、2g | B、1.6g |
| C、1g | D、1.8g |
考点:化学方程式的有关计算
专题:计算题
分析:1.4g铁全部溶于盐酸中,Fe+2HCl═FeCl2+H2↑,加入足量NaOH溶液,FeCl2+2NaOH=Fe(OH)2↓+2NaCl,氢氧化亚铁在空气中易被氧化为氢氧化铁;4Fe(OH)2+O2+2H2O=4Fe(OH)3,4Fe(OH)3
2Fe2O3+6H2O,最后得到红色物质是Fe2O3,根据铁元素守恒计算.
| ||
解答:
解:1.4g铁n(Fe)=
=
=0.025mol,全部溶于盐酸中,Fe+2HCl═FeCl2+H2↑,加入足量NaOH溶液,FeCl2+2NaOH=Fe(OH)2↓+2NaCl,氢氧化亚铁在空气中易被氧化为氢氧化铁;4Fe(OH)2+O2+2H2O=4Fe(OH)3,4Fe(OH)3
2Fe2O3+6H2O,最后得到红色物质是Fe2O3,根据铁元素守恒m(Fe2O3)=0.025mol×
,m(Fe2O3)=nM=0.025mol×
×160g/mol=2g,
故选A.
| m |
| M |
| 1.4g |
| 56g/mol |
| ||
| 1 |
| 2 |
| 1 |
| 2 |
故选A.
点评:本题考查学生利用金属与酸的反应来进行的简单计算,根据铁元素守恒计算是解答关键,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
可逆反应mA(g)?nB(g)+pC(s)△H=QKJ/moL,温度和压强的变化对正、逆反应速率的影响分别符合图中的两个图象,以下叙述正确的是( )


| A、m>n,Q>0 |
| B、m<n+p,Q>0 |
| C、m>n,Q<0 |
| D、m>n+p,Q<0 |
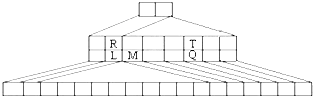 如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )
如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )| A、Q、T两元素的氢化物的稳定性为HnT<HnQ |
| B、L、R的单质与盐酸反应速率为R>L |
| C、M与T形成的化合物有两性 |
| D、L、Q形成的简单离子核外电子数相等 |
下列说法不正确的是( )
①形成化学键的过程一定是化学变化
②离子化合物中一定含有金属元素
③物质有阳离子必有阴离子
④含有金属元素的离子一定为阳离子
⑤单质中一定含有共价键
⑥干冰升华破坏化学键
⑦HCI溶于水中电离出H+和Cl-,因此HCl中含有离子键.
①形成化学键的过程一定是化学变化
②离子化合物中一定含有金属元素
③物质有阳离子必有阴离子
④含有金属元素的离子一定为阳离子
⑤单质中一定含有共价键
⑥干冰升华破坏化学键
⑦HCI溶于水中电离出H+和Cl-,因此HCl中含有离子键.
| A、①②③④⑤⑥⑦ |
| B、②③④⑤⑥⑦ |
| C、③⑤⑥⑦ |
| D、①②③④⑤⑥ |
已知短周期元素的离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是( )
| A、原子半径:A>B>C>D |
| B、原子序数:d>c>b>a |
| C、离子半径:C3->D->B+>A2+ |
| D、元素的第一电离能:A>B>D>C |
物质发生化学变化时,下列量在反应前后肯定不发生变化的是( )
①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥质子总数.
①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥质子总数.
| A、①②③⑤ | B、①②⑤⑥ |
| C、②③⑤⑥ | D、①④⑤ |
在下列反应中,Na2O2只表现出氧化性不表现出还原性的是( )
| A、Na2O2+SO2═Na2SO4 |
| B、2Na2O2+2CO2═2Na2CO3 +O2↑ |
| C、2Na2O2+2H2O═4NaOH+O2↑ |
| D、5Na2O2+MnO4-+16H+═10Na++2Mn2++5O2↑+8H2O |
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
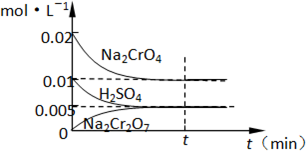 (1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:
(1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为: