题目内容
2.下列各组中互为同分异构的是( )| A. | 12C 14C | B. | O2 O3 | ||
| C. | SO2 SO3 | D. | CH3CH2COOH 与CH3COOCH3 |
分析 同分异构体指分子式相同、结构不同的化合物,据此根据物质的组成及化学式进行判断.
解答 解:A.12C、14C具有相同的质子数、不同的中子数,二者互为同位素,故A错误;
B.O2、O3为同种元素形成的不同单质,二者互为同素异形体,故B错误;
C.SO2、SO3为S的两种氧化物,二者分子式不同,不属于同分异构体,故C错误;
D.CH3CH2COOH与CH3COOCH3的分子式相同、结构不同,二者互为同分异构体,故D正确;
故选D.
点评 本题考查同分异构体的概念及判断,题目难度不大,明确同分异构体的概念为解答关键,注意掌握同位素、同分异构体、同素异形体等之间的区别,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.已知还原性I->Fe2+>Br-,下列离子方程式正确的是( )
| A. | 将少量Cl2通入FeBr2溶液中:Cl2+2Br-═Br2+2Cl- | |
| B. | 将足量Cl2通入FeBr2溶液中:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 将少量Cl2通入FeI2溶液中:2Fe2++2I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 将672mLCl2(标况)通入250mL 0.1molL-1的FeI2溶液中:2Fe2++10I-+6Cl2═12Cl-+5I2+2Fe3+ |
10.某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)偏大.
(2)判断滴定终点的现象是:无色变为粉红色,半分钟内不变色.
(3)根据下列数据:请计算待测盐酸溶液的浓度:0.20mol/L.
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)偏大.
(2)判断滴定终点的现象是:无色变为粉红色,半分钟内不变色.
(3)根据下列数据:请计算待测盐酸溶液的浓度:0.20mol/L.
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00- | 24.00 |
7.根据不同的分类标准,同一物质可以归属不同的物质类别.K2CO3是一种盐,但不属于( )
| A. | 碳酸盐 | B. | 钾盐 | C. | 酸式盐 | D. | 正盐 |
14.化学与生产、生活密切相关.下列说法不正确的是( )
| A. | pH<7的降水成为酸雨 | |
| B. | 硅酸钠可用于制备木材防火剂 | |
| C. | 水泥、陶瓷、玻璃都属于硅酸盐产品 | |
| D. | 冬季大量使用燃煤取暖会导致雾霾的形成 |
11.碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如图所示,下列有关说法正确的是( )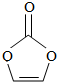

| A. | 分子式为C3H2O3 | B. | 分子中只含有极性键 | ||
| C. | 分子中含6个σ键 | D. | 各碳原子杂化的方式不同 |
12.下列图示与对应的叙述一定正确的是( )
| A. | 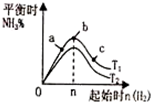 表示合成氨(放热反应),温度T1和T2对应的平衡常数为K1,K2、則:T1<T2,K1>K2 | |
| B. | 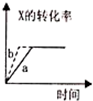 反应:X(g)+2Y(g)?3Z(g),b的溫度比a可能高 | |
| C. | 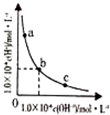 该温度下,加人FeCl3不可能引起出由b向a的变化 | |
| D. | 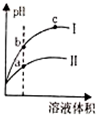 用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
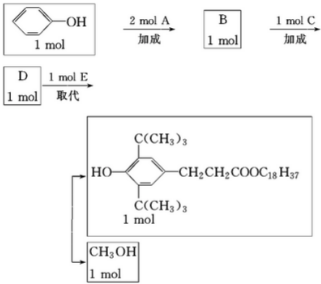
 +
+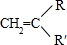 →
→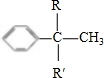
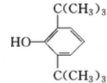 ,C:CH2=CHCOOCH3,D:
,C:CH2=CHCOOCH3,D: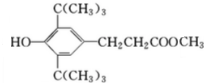 ,E:C18H37OH.
,E:C18H37OH. 属醇类化合物(填“醇”或“酚”)
属醇类化合物(填“醇”或“酚”) B.
B.
 D.
D. E.
E.