题目内容
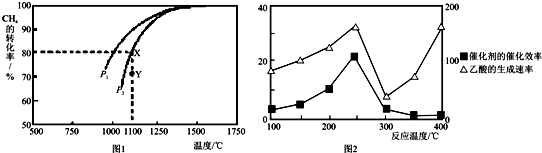
12.下列图示与对应的叙述一定正确的是( )| A. | 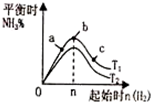 表示合成氨(放热反应),温度T1和T2对应的平衡常数为K1,K2、則:T1<T2,K1>K2 | |
| B. | 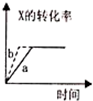 反应:X(g)+2Y(g)?3Z(g),b的溫度比a可能高 | |
| C. | 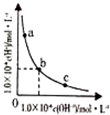 该温度下,加人FeCl3不可能引起出由b向a的变化 | |
| D. | 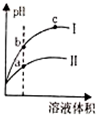 用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
分析 A、合成氨的反应为放热反应,温度越高,平衡左移,氨气的百分含量越小;
B、b曲线表示的反应比a反应速率快,平衡不移动;
C、温度不变,Kw不变,而氯化铁溶于水后水解显酸性;
D、图象分析,醋酸是弱电解质存在电离平衡,稀释相同倍数,强酸pH变化大.
解答 解:A、合成氨的反应为放热反应,温度越高,平衡左移,氨气的百分含量越小,根据图象可知,温度T1<T2,而氨气的百分含量越高,说明平衡向右进行的程度越大,则K值越大,故有:K1>K2,故A正确;
B、图1所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的可以是增大压强,还可能是使用催化剂,温度变化平衡一定发生变化,图象不符合,故B错误;
C、温度不变,Kw不变,而氯化铁溶于水后水解显酸性,故氯化铁溶于水后溶液中的c(H+)变大,而c(OH-)变小,即可以由a转化为b点,故C错误;
D、图象分析,醋酸是弱电解质存在电离平衡,稀释相同倍数,强酸pH变化大,Ⅰ表示盐酸,Ⅱ表示醋酸,导电性a>b>c,故D错误.
故选A.
点评 本题考查了图象分析判断的能力,主要是化学反应有些因素的分析理解,饱和溶液的质量分数分析判断,弱电解质电离平衡的分析应用,题目难度中等.

练习册系列答案
相关题目
2.下列各组中互为同分异构的是( )
| A. | 12C 14C | B. | O2 O3 | ||
| C. | SO2 SO3 | D. | CH3CH2COOH 与CH3COOCH3 |
20.下列实验中,结论正确且与现象具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 在 CuSO4溶液中加入一小块Na | Na溶解,生成沉淀 | 有Cu产生 |
| B | 将浓氨水滴加至烧瓶中的CaO上 | 产生的气体可使湿润的红色石蕊试纸变蓝 | 有氨气生成 |
| C | 在Fe(NO3)2溶液中加入稀H2SO4 | 溶液变为黄色 | 稀H2SO4具有氧化性 |
| D | 将氨气通入I2-淀粉溶液中 | 溶液蓝色褪去 | 氯气具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
7.1mol某链烃最多可与2mol H2发生加成反应生成化合物A,化合物A最多能与12mol Cl2发生取代反应生成化合物B,则下列有关说法正确的是( )
| A. | 该烃分子内既有碳碳双键又有碳碳三键 | |
| B. | 该烃分子内碳原子数超过6 | |
| C. | 该烃能发生氧化反应和加聚反应 | |
| D. | 化合物B有两种同分异构体 |
4.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 1molFeCl3水解生成的Fe(OH)3胶粒数为1NA | |
| B. | 4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5NA | |
| C. | 标准状况下,11.2LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 1mol•L-1AlCl3溶液中含有3NA个Cl- |
1.最近中美研究人员发明了一种可快速充电放电的铝离子电池,该电池电解质为离子液体,离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液,放电过程中不产生其他离子且有机阳离子不参与电极反应,放电时有关离子转化如图所示,下列说法正确的是( )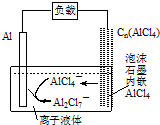

| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl7-+Cl- | |
| B. | 放电时,电路中每流过3mol电子,正极减少27g | |
| C. | 充电时,泡沫石墨极与外电源的负极相连 | |
| D. | 充电时,阴极发生:4Al2Cl7-+3e-=Al+7AlCl4- |
 CH4(g)+H2O(g)△H=-203kJ•mol-1.
CH4(g)+H2O(g)△H=-203kJ•mol-1.