题目内容
18.X、Y、Z、W、R属于短周期主族元素.X的原子半径是短周期主族元素中最大的,Y元素的单质通过分离液态空气得到,Z元素的单质是常见的半导体材料,W与Z同族,R与Y同族,其单质有杀菌作用.下列叙述不正确的是( )
| A. | 与Z同族的第五周期元素的原子序数为50 | |
| B. | Y的简单氢化物的沸点和热稳定性均大于R的简单氢化物 | |
| C. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2,且均能与水反应 | |
| D. | 由W和Z组成的ZW物质硬度大、熔沸点高,具有导磁性 |
分析 X、Y、Z、W、R属于短周期主族元素.X的原子半径是短周期主族元素中最大的,则X为Na;Y元素的单质常通过分离液态空气得到,Y单质为氮气或氧气,而R与Y同族,其单质有杀菌作用,则Y为O元素、R为S元素;Z元素的单质是常见的半导体材料,则Z为Si,W与Z同族,则W为C元素,据此解答.
解答 解:X、Y、Z、W、R属于短周期主族元素.X的原子半径是短周期主族元素中最大的,则X为Na;Y元素的单质常通过分离液态空气得到,Y单质为氮气或氧气,而R与Y同族,其单质有杀菌作用,则Y为O元素、R为S元素;Z元素的单质是常见的半导体材料,则Z为Si,W与Z同族,则W为C元素.
A.与Z(Si)同族的第五周期元素的原子序数为14+18+18=50,故A正确;
B.Y、R的简单氢化物分别为H2O、H2S,H2O分子之间存在氢键,沸点高于H2S,由于非金属性O>S,故稳定性:H2O>H2S,故B正确;
C.X与Y形成的两种化合物为Na2O、Na2O2,晶体中阴、阳离子的个数比均为1:2,前者与水反应生成氢氧化钠,后者与水反应是生成氢氧化钠与氧气,故C正确;
D.由W和Z组成的SiC属于原子晶体,物质硬度大、熔沸点高,没有导磁性,故D错误.
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素化合物性质的掌握,难度中等

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目
6.下列实验装置图与对应的现象或结论的叙述均正确的是( )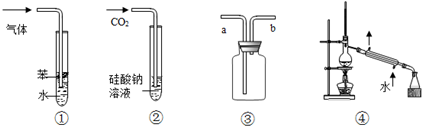

| A. | 装置①:可用于吸收NH3或HCl气体,并防止倒吸 | |
| B. | 装置②:持续通入CO2气体,先出现白色沉淀,后变澄清 | |
| C. | 装置③:若“a进b出”可用于收集NO2,若“b进a出”可用于收集NH3 | |
| D. | 装置④:可用于分离石油,得到汽油、煤油和柴油等各种纯净物 |
6.已知:碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I-═I3-.通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数.
某同学为测定上述平衡体系中c(I2),采用如下方法:取V1mI平衡混合溶液,用c mol/L的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3═2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液.根据V1、V2和c可求得c(I2).下列对该同学设计方案的分析,正确的是( )
某同学为测定上述平衡体系中c(I2),采用如下方法:取V1mI平衡混合溶液,用c mol/L的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3═2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液.根据V1、V2和c可求得c(I2).下列对该同学设计方案的分析,正确的是( )
| A. | 方案可行.能准确测定溶液中的c(I2) | |
| B. | 方案可行,可采用淀粉做该滴定反应的指示剂 | |
| C. | 不可行.只能测得溶液中c(I2)与c(I3-)之和 | |
| D. | 不可行.因为I-能与Na2S2O3发生反应 |
10.中学化学中的常见物质甲、乙、丙、丁存在如图所示转化关系(反应条件省略),下列说法正确的是( )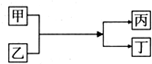

| A. | 若甲为铜,丁为氯化亚铁,则乙一定是氯化铁 | |
| B. | 若甲为水,丁为氢氧化钠,则丙一定是氢气 | |
| C. | 若甲为铝,丁为铁,则乙一定是氧化铁 | |
| D. | 若甲为镁,丁为氢气.则乙一定是酸 |
8.0.1mol/L的KOH与等浓度等体积的草酸(H2C2O4)溶液混合后,溶液呈酸性,则下列的说法正确的是( )
| A. | 溶液呈酸性说明草酸是弱酸 | B. | c(K+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-) | ||
| C. | c(K+)>c(HC2O4-)>c(C2O42-)>c(H+) | D. | c(H2C2O4)>c(C2O42-) |
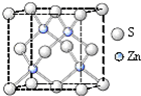 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答: