题目内容
3.铜单质及其化合物在很多領域中都有重要的用途.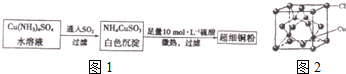
(1)超细镉粉可用作导电材料、催化剂等,其制备方法如图1:
①下列说法正确的是ade
a.Cu(NH3)4SO4中所含的化学键有离子键、极性键和配位键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4的组成元素中第-电离能最大的是氧元素
d.Cu(NH3)4SO4中外界离子的空间构型为正四面体
e.SO${\;}_{3}^{2-}$中硫原子的杂化方式为sp3杂化
②在CuSO4溶液中加氨水生成蓝色沉淀.再加氨水沉淀溶解,得到深蓝色透明溶液,
最后向该溶液中加人一定量乙醇,析出Cu(NH3)4SO4•H2O晶体.请解释加入乙醇后析出晶体的原因乙醇分子极性比水的极性弱,加入乙醇降低溶剂的极性,减小溶质的溶解度
③写出向Cu(NH3)4SO4,水溶液中通人SO2时发生反应的离子方程式2[Cu(NH3)4]2++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-
④NH4CuSO3中金属阳离子的核外电子排布式为1s22s22p63s23p63d10;CuO高温易转化为Cu2O,其原因是Cu+离子的核外电子为全满稳定状态
⑤含有元素铜的化合物焰色反应为绿色,许多金属盐都可以发生焰色反应.其原因是电子由较高能级跃迁到较低能级时,以光的形式释放能量
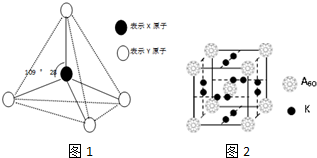
(2)M原子的外围电子排布式3s23p5与铜形成化合物的晶胞如图2所示(黑点代表铜原子).
①该晶体的化学式为CuCl
②已知铜和M的电负性分别为1.9和3.0.则铜与M形成的化合物属于共价(填“离子”、“共价”)化合物.
③已知该晶体的密度为dg•cm-3阿伏伽德罗常数NA,则该晶体中铜原子和M原子之间的最短距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm(只写计算式)
分析 (1)①a.Cu(NH3)4SO4中铜离子与氨气分子之间形成配位键,硫酸根与配离子之间形成离子键,氨气分子中N原子与H原子之间、硫酸根中S原子与O氧原子之间形成极性键;
b.NH3分子为三角锥形,H2O分子为V形,水分子中O原子有2对孤对电子,氨气分子中N原子有1对孤对电子,孤对电子之间排斥大于孤对电子与成键电子对之间的排斥;
c.一般非金属性越强第一电离能越大,N元素原子2p能级为半满稳定状态,第一电离能高于氧元素的;
d.Cu(NH3)4SO4中外界离子为SO42-,计算S原子孤对电子、价层电子对数确定空间构型;
e.SO32-中硫原子价层电子对数=3+$\frac{6+2-2×3}{2}$=4,杂化轨道数目为4;
②乙醇分子极性比水的极性弱,加入乙醇降低溶剂的极性,减小溶质的溶解度;
③由流程图可知,向Cu(NH3)4SO4水溶液中通入SO2时生成NH4CuSO3沉淀,Cu元素发生还原反应,则SO2发生氧化反应生成硫酸,氢离子与氨气分子结合为铵根离子;
④NH4CuSO3中金属阳离子为Cu+,Cu原子失去4s能级1个电子形成Cu+;Cu+离子的核外电子为全满稳定状态
⑤电子由较高能级跃迁到较低能级时,以光的形式释放能量;
(2)M原子的外围电子排布式3s23p5,则M为Cl.
①根据均摊法计算晶胞中Cu、Cl原子数目,进而确定晶体的化学式;
②电负性之差大于1.7形成离子键,小于1.7形成共价键;
③Cu原子与周围的4个Cu原子形成正四面体结构,正四面体中Cu与Cl原子距离最近,Cu原子晶胞顶点原子连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,而晶胞体对角线长度为晶胞棱长的$\sqrt{3}$倍,结合原子数目计算晶胞质量,再结合密度计算晶胞体积,可得晶胞棱长.
解答 解:(1)①a.Cu(NH3)4SO4中铜离子与氨气分子之间形成配位键,硫酸根与配离子之间形成离子键,氨气分子中N原子与H原子之间、硫酸根中S原子与O氧原子之间形成极性键,故a正确;
b.NH3分子为三角锥形,H2O分子为V形,水分子中O原子有2对孤对电子,氨气分子中N原子有1对孤对电子,孤对电子之间排斥大于孤对电子与成键电子对之间的排斥,则氨气分子的键角大于水分子的键角,故b错误;
c.一般非金属性越强第一电离能越大,N元素原子2p能级为半满稳定状态,第一电离能高于氧元素的,故第一电离能N>O>S>H>Cu,故c错误;
d.Cu(NH3)4SO4中外界离子为SO42-,S原子孤对电子为$\frac{6+2-2×4}{2}$=0、价层电子对数为4+9=4,故空间构型为正四面体,故d正确;
e.SO32-中硫原子价层电子对数=3+$\frac{6+2-2×3}{2}$=4,杂化轨道数目为4,S原子采取sp3杂化,故e正确,
故选:ade;
②乙醇分子极性比水的极性弱,加入乙醇降低溶剂的极性,减小溶质的溶解度,析出Cu(NH3)4SO4•H2O晶体,
故答案为:乙醇分子极性比水的极性弱,加入乙醇降低溶剂的极性,减小溶质的溶解度;
③由流程图可知,向Cu(NH3)4SO4水溶液中通入SO2时生成NH4CuSO3沉淀,Cu元素发生还原反应,则SO2发生氧化反应生成硫酸,氢离子与氨气分子结合为铵根离子,反应离子方程式为:2[Cu(NH3)4]2++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-,
故答案为:2[Cu(NH3)4]2++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-;
④NH4CuSO3中金属阳离子为Cu+,Cu原子失去4s能级1个电子形成Cu+,Cu+核外电子排布式为:1s22s22p63s23p63d10,Cu+离子的核外电子为全满稳定状态,Cu2O较稳定,CuO高温易转化为Cu2O,
故答案为:1s22s22p63s23p63d10;Cu+离子的核外电子为全满稳定状态;
⑤电子由较高能级跃迁到较低能级时,以光的形式释放能量,
故答案为:电子由较高能级跃迁到较低能级时,以光的形式释放能量;
(2)M原子的外围电子排布式3s23p5,则M为Cl.
①晶胞中Cu原子处于晶胞内部,共有4个,Cl原子处于顶点与面心,Cl原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故化学式为CuCl,故答案为:CuCl;
②电负性之差大于1.7形成离子键,小于1.7形成共价键,铜和M的电负性之差俄日3.0-1.9=1.1<1.7,则铜与M形成的化合物属于共价化合物,故答案为:共价;
③Cu原子与周围的4个Cu原子形成正四面体结构,正四面体中Cu与Cl原子距离最近,Cu原子晶胞顶点原子连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,而晶胞体对角线长度为晶胞棱长的$\sqrt{3}$倍,晶胞质量为4×$\frac{64+35.5}{{N}_{A}}$g,则晶胞棱长=$\root{3}{\frac{4×\frac{64+35.5}{{N}_{A}}g}{dg•c{m}^{-3}}}$=$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm,故该晶体中铜原子和M原子之间的最短距离为$\frac{1}{4}$×$\sqrt{3}$×$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$.
点评 本题是对物质结构与性质的考查,涉及配合物、化学键、核外电子排布、电离能、杂化方式与空间构型、晶胞计算等,(2)中距离计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力.

( )
| A. | 与Z同族的第五周期元素的原子序数为50 | |
| B. | Y的简单氢化物的沸点和热稳定性均大于R的简单氢化物 | |
| C. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2,且均能与水反应 | |
| D. | 由W和Z组成的ZW物质硬度大、熔沸点高,具有导磁性 |
| A. | 在医疗上碳酸钠可用于治疗胃酸过多 | |
| B. | 家用铁锅用水清洗后置于干燥处,能减缓电化学腐蚀 | |
| C. | 清洁能源所用光电池的生产材料主要是高纯度的二氧化硅 | |
| D. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 |
| A. | 长期放置的漂白粉是因与空气中的氧气发生反应而变质 | |
| B. | 粗硅提纯是利用H2作还原剂,将硅从其氯化物中还原出来 | |
| C. | 利用半透膜除去海水中的NaCl、MgCl2等离子化合物可获得淡水 | |
| D. | 工业上用铝热反应来冶炼Fe、Cr、Mn、V等稀有金属 |

(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除去杂质、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2 mol•L-1 HCl、1 mol•L-1 H2SO4、0.1 mol•L-1 NaOH、0.1 mol•L-1BaCl2、蒸馏水.仪器和用品自选.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
| A. | 金属、非金属、稀有气体 | B. | 化合物、盐、酸式盐 | ||
| C. | 碱、碱性氧化物、碱式盐 | D. | 混合物、化合物、纯净物 |
 .
.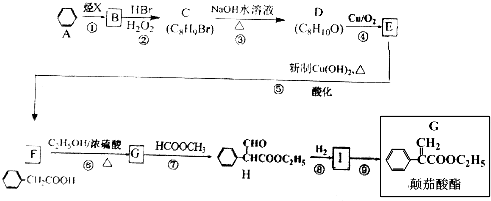
 ;
;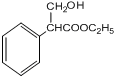 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$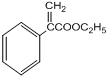 +H2O;
+H2O;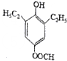 、
、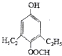
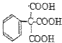 的合成路线流程图(无机试剂自选),合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂自选),合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.