题目内容
20.一定温度下在恒容的容器中发生如下反应:A(s)+2B(g)?C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )①混合气体的密度 ②混合气体的压强 ③混合气体的总物质的量 ④B的物质的量浓度.
| A. | ①④ | B. | 仅②③ | C. | ②③④ | D. | 仅④ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①混合气体的密度不变,说明气体的质量不变,反应达平衡状态,故正确;
②两边气体的计量数相等,所以混合气体的压强一直不变,故错误;
③混合气体的总物质的量一直不变,故错误;
④B的物质的量浓度,说明正逆反应速率相等,反应达平衡状态,故正确;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 电解NaCl饱和溶液,可制得金属钠 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 寻找高效催化剂,利用太阳能分解水是制取氢气的较理想方法 | |
| D. | MgO的熔点很高,可用于制作耐高温材料 |
8.在MnO2+4HCl═MnCl2+Cl2↑+2H2O 反应中氧化剂与还原剂分子数之比为( )
| A. | 1:4 | B. | 1:2 | C. | 2:1 | D. | 1:1 |
5.以下物质间的每步转化,存在不能通过一步反应实现的是( )
| A. | S→SO2→SO3→H2SO4 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Al→Al2O3→Al(OH)3→NaAlO2 | D. | N2→NO→NO2→HNO3 |
12.一定条件下,可逆反应:H2(g)+I2(g)?2HI(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
| A. | 混合气体的颜色不再改变 | B. | 混合气体的密度不再改变 | ||
| C. | 混合气体的压强不再改变 | D. | 混合气体的平均分子质量不再改变 |
6. 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H 1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H 2
①表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
由表中数据判断△H1<0 (填“>”、“=”或“<”).
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-442.8kJ•mol-1
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:
①该电池正极的电极反应为O2+2H2O+4e-=4OH-
②该电池总反应的离子方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O
③工作一段时间后,测得溶液的pH减小(填“增大”、“减小”或“不变”).
 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H 1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H 2
①表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-442.8kJ•mol-1
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:
①该电池正极的电极反应为O2+2H2O+4e-=4OH-
②该电池总反应的离子方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O
③工作一段时间后,测得溶液的pH减小(填“增大”、“减小”或“不变”).
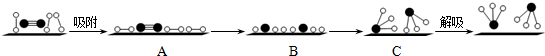
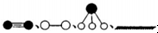 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示: