题目内容
11.乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成.回答下列问题:
(1)B和A为同系物,B的结构简式为CH2=CHCH3.
(2)反应①的反应类型为加成反应.
(3)反应③的化学方程式为CH2=CHCH2Cl+NaOH$→_{△}^{H_{2}O}$CH2=CHCH2OH+NaCl.
(4)C的结构简式为HOOC-COOH.
(5)反应②的化学方程式为HOOC-COOH+2CH3CH2OH$?_{△}^{浓硫酸}$CH3CH2OOCCOOCH2CH3+2H2O.
分析 C2H6O与C反应生成D,由D的结构简式可知C为HOOC-COOH,C2H6O为CH3CH2OH,则A为CH2=CH2,与水发生加成反应生成乙醇;C3H5Cl发生卤代烃的水解反应生成CH2=CHCH2OH,则C3H5Cl为CH2=CHCH2Cl,B为CH2=CHCH3,CH2=CHCHO发生氧化反应得到HOOC-COOH.
解答 解:C2H6O与C反应生成D,由D的结构简式可知C为HOOC-COOH,C2H6O为CH3CH2OH,则A为CH2=CH2,与水发生加成反应生成乙醇;C3H5Cl发生卤代烃的水解反应生成CH2=CHCH2OH,则C3H5Cl为CH2=CHCH2Cl,B为CH2=CHCH3,CH2=CHCHO发生氧化反应得到HOOC-COOH,
(1)通过以上分析知,B的结构简式为CH2=CHCH3,故答案为:CH2=CHCH3;
(2)反应①为乙烯和水的加成反应,所以该反应的反应类型为加成反应,故答案为:加成反应;
(3)反应③是CH2=CHCH2Cl发生水解反应生成CH2=CHCH2OH,反应③的化学方程式为CH2=CHCH2Cl+NaOH$→_{△}^{H_{2}O}$CH2=CHCH2OH+NaCl,
故答案为:CH2=CHCH2Cl+NaOH$→_{△}^{H_{2}O}$CH2=CHCH2OH+NaCl;
(4)C的结构简式为HOOC-COOH,故答案为:HOOC-COOH;
(5)反应②是乙二酸与乙醇发生酯化反应生成乙二酸二乙酯,化学方程式为:HOOC-COOH+2CH3CH2OH$?_{△}^{浓硫酸}$CH3CH2OOCCOOCH2CH3+2H2O,
故答案为:HOOC-COOH+2CH3CH2OH$?_{△}^{浓硫酸}$CH3CH2OOCCOOCH2CH3+2H2O.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确有机物官能团及其性质关系、物质之间的转化是解本题关键,根据某些物质的结构简式结合反应条件采用正逆结合的方法进行推断,题目难度不大.

| A. | 构成原电池正极和负极的材料必须是两种活动性不同的金属 | |
| B. | 由CH4、O2和KOH构成的燃料电池中,通入CH4的电极为正极 | |
| C. | 原电池工作时,负极发生氧化反应,化合价降低 | |
| D. | 铜锌原电池工作时,当有13 g锌溶解时,电路中有0.4 mol电子通过 |
| A. | 易溶于水的物质一定是电解质 | B. | 液态氯化氢能导电 | ||
| C. | 氯化钠晶体是电解质 | D. | 液态氯是非电解质 |
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4,原子半径最大的是① | |
| B. | 下列原子的价电子排布中,①3s23p1②3s23p2③3s23p3 ④3s23p4,对应的第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④ | |
| D. | 某元素的逐级电离能(kJ•mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是X3+ |
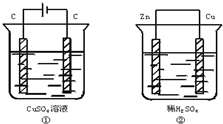 如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )
如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )| A. | 产生气体的体积:①>② | |
| B. | 电极总质量的变化:①增加,②减小 | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | 电极反应式:①装置中的阳极:4OH--4e-→2H2O+O2↑ ②装置中的负极:2H++2e-→H2↑ |
| A. | 生石灰、硫、熟石灰 | B. | 液态氧、胆矾、Fe(OH)3胶体 | ||
| C. | 铁、浓硫酸、氯化氮 | D. | 氮气、碘酒、碱式碳酸铜 |
| A. | 7.8gNa2O2中含有的阴离子数目为0.2Na | |
| B. | 标准状况下,2.24LCHCl3的分子数为0.1NA | |
| C. | 0.1molFe与足量稀HNO3反应,转移电子数为0.3NA | |
| D. | 1L 0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA |
 ,
, ,
,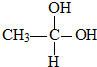 →CH3-CHO+H2O
→CH3-CHO+H2O
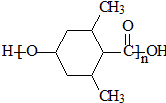 ]
]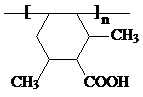 ;
;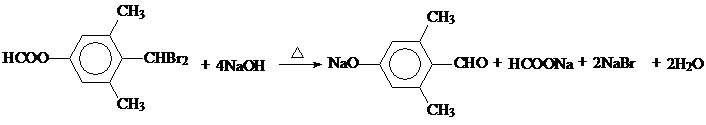 ;
; ;
;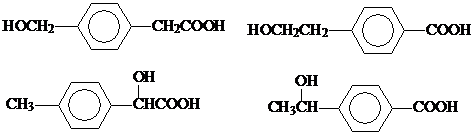 (任写一个).
(任写一个).