题目内容
已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+);②c(Na+)>c(CH3COO-)>c(H+)>c(OH-);
③c(CH3COO-)=c(Na+)>c(H+)=c(OH-);④c(Na+)>c(OH-)>c(CH3COO-)>c(H+).
(1)若溶液中只溶解了一种溶质,则该溶液中离子浓度的大小顺序为 (填编号).
(2)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好反应,则混合前两溶液的物质的量浓度大小关系为c(NaOH) c(CH3COOH)(填“>”、“<”或“=”,下同),混合前碱中c(OH-)和酸中c(H+)的关系是c(OH-) c(H+).
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好是中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH) c(CH3COOH)(填“>”、“<”或“=”),混合后溶液中的离子浓度的大小关系为 (填编号).
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+);②c(Na+)>c(CH3COO-)>c(H+)>c(OH-);
③c(CH3COO-)=c(Na+)>c(H+)=c(OH-);④c(Na+)>c(OH-)>c(CH3COO-)>c(H+).
(1)若溶液中只溶解了一种溶质,则该溶液中离子浓度的大小顺序为
(2)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好反应,则混合前两溶液的物质的量浓度大小关系为c(NaOH)
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好是中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH)
考点:离子浓度大小的比较,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:①溶液呈碱性,可能为CH3COONa溶液;
②不符合电中性原则,故不存在此溶液;
③c(H+)=c(OH-),溶液呈中心,可以是醋酸钠与醋酸的混合物;
④溶液呈碱性,且氢氧根浓度大于醋酸根浓度,故此溶液可能是氢氧化钠与醋酸钠的混合物,据此解答各小题即可.
②不符合电中性原则,故不存在此溶液;
③c(H+)=c(OH-),溶液呈中心,可以是醋酸钠与醋酸的混合物;
④溶液呈碱性,且氢氧根浓度大于醋酸根浓度,故此溶液可能是氢氧化钠与醋酸钠的混合物,据此解答各小题即可.
解答:
解:(1)依据分析可知:①c(CH3COO-)>c(Na+)>c(H+)>c(OH-),此溶液可能为醋酸钠溶液,故答案为:①;
(2)该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好反应,那么产物恰好是醋酸钠与水,氢氧化钠的浓度=醋酸的浓度,由于氢氧化钠为强碱,故完全电离,醋酸为弱酸,部分电离,故碱中氢氧根浓度大于酸中氢离子浓度,故答案为:=;>;
(3)该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好是中性,那么c(H+)=c(OH-)由于醋酸是弱酸,故醋酸稍微过量,即c(NaOH)<c(CH3COOH),由于:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(CH3COO-)=c(Na+)>c(H+)=c(OH-),故答案为:<;③.
(2)该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好反应,那么产物恰好是醋酸钠与水,氢氧化钠的浓度=醋酸的浓度,由于氢氧化钠为强碱,故完全电离,醋酸为弱酸,部分电离,故碱中氢氧根浓度大于酸中氢离子浓度,故答案为:=;>;
(3)该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好是中性,那么c(H+)=c(OH-)由于醋酸是弱酸,故醋酸稍微过量,即c(NaOH)<c(CH3COOH),由于:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(CH3COO-)=c(Na+)>c(H+)=c(OH-),故答案为:<;③.
点评:本题主要考查的是离子浓度的大小比较,注意溶液恰好完全反应与恰好呈中性的判定与区别,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列有关离子方程式正确的是( )
| A、向稀盐酸中加入少量钠粒:2Na+2H2O=2Na++2OH-+H2↑ |
| B、向氯化铁溶液中滴加偏铝酸钠溶液:Fe3++3AlO2-+6H2O=Fe(OH)3↓+3Al(OH)3↓ |
| C、Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO3-+OH-=MgCO3↓+H2O |
| D、向含氯化铝的氯化镁溶液中加入氧化镁:Al3++MgO+H2O=Al(OH)3↓+Mg2+ |
要除去Fe2O3中混有的Al2O3,最好的方法是( )
| A、用NaOH洗涤、过滤 |
| B、用H2加热还原 |
| C、用CO加热还原 |
| D、用盐酸洗涤过滤 |
下列分子均属于极性分子且中心原子均为sp3杂化的是( )
| A、SO2、BF3 |
| B、PCl3、SO3 |
| C、CH4、SiO2 |
| D、NF3、H2S |
下列排列顺序正确的是( )
| A、常温下将0.1 mol?L-1 CH3COONa溶液与0.05 mol?L-1 HCl溶液等体积混合,c (Na+)>c (Cl-)>c(CH3COO-)>c (OH-)>c (H+) |
| B、常温下物质的量浓度相等的①NH4HSO4;②(NH4 )2CO3;③NH4Cl三种溶液中c(NH4+):①>③>② |
| C、常温下0.1mol?L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A) |
D、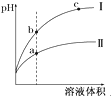 某温度下,相同pH的酸Ⅰ和酸Ⅱ溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断相同条件下酸性:Ⅰ>Ⅱ 某温度下,相同pH的酸Ⅰ和酸Ⅱ溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断相同条件下酸性:Ⅰ>Ⅱ |
下列溶液中各微粒的浓度关系不正确的是( )
| A、0.1 mol?L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B、1 L 0.1 mol?L-1 CuSO4?(NH4)2SO4?6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) |
| C、0.1 mol?L-1 NaHSO3溶液中:c(H+)+c(H2SO3)=c(SO32-)+c(OH-) |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
下列有关电解质溶液的说法正确的是( )
| A、将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干均得不到原溶质 |
| B、保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解 |
| C、室温下,向0.1mol/L的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大 |
| D、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
