题目内容
下列排列顺序正确的是( )
| A、常温下将0.1 mol?L-1 CH3COONa溶液与0.05 mol?L-1 HCl溶液等体积混合,c (Na+)>c (Cl-)>c(CH3COO-)>c (OH-)>c (H+) |
| B、常温下物质的量浓度相等的①NH4HSO4;②(NH4 )2CO3;③NH4Cl三种溶液中c(NH4+):①>③>② |
| C、常温下0.1mol?L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A) |
D、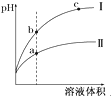 某温度下,相同pH的酸Ⅰ和酸Ⅱ溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断相同条件下酸性:Ⅰ>Ⅱ 某温度下,相同pH的酸Ⅰ和酸Ⅱ溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断相同条件下酸性:Ⅰ>Ⅱ |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡
专题:
分析:A.混合后溶液中含等浓度的NaCl、CH3COOH及CH3COONa,酸与盐的混合溶液显酸性;
B.设各溶液的浓度都为1mol/L,①NH4HSO4中氢离子抑制铵根离子的水解,②(NH4 )2CO3中发生相互促进水解,但碳酸铵的化学式中含有2个铵根离子,水解程度减小,③NH4Cl中铵根离子水解则铵根离子的浓度小于1mol/L,据此判断三种溶液中c(NH4+)的大小;
C.pH=11,则HA-的水解程度大于其电离程度,水解生成H2A,电离生成A2-;
D.稀释相同倍数时,酸性越强,pH变化越大,则据图判断同条件下酸性大小.
B.设各溶液的浓度都为1mol/L,①NH4HSO4中氢离子抑制铵根离子的水解,②(NH4 )2CO3中发生相互促进水解,但碳酸铵的化学式中含有2个铵根离子,水解程度减小,③NH4Cl中铵根离子水解则铵根离子的浓度小于1mol/L,据此判断三种溶液中c(NH4+)的大小;
C.pH=11,则HA-的水解程度大于其电离程度,水解生成H2A,电离生成A2-;
D.稀释相同倍数时,酸性越强,pH变化越大,则据图判断同条件下酸性大小.
解答:
解:A.混合液中含等量的NaCl、CH3COOH及CH3COONa,酸与盐的混合溶液显酸性,则c(H+)>c(OH-),故A错误;
B.设各溶液的浓度都为1mol/L,①NH4HSO4中氢离子抑制铵根离子的水解,则①中铵根离子的浓度最接近1mol/L,②(NH4 )2CO3中发生相互促进水解,由于碳酸铵的化学式中含有2个铵根离子,水解程度减小,则其溶液中铵根离子浓度大于0.1mol/L,③NH4Cl中铵根离子水解则铵根离子的浓度小于1mol/L,所以三种溶液中c(NH4+)的大小关系为:②>①>③,故B错误;
C.pH=11,则HA-的水解程度大于其电离程度,水解生成H2A,电离生成A2-,则:c(H2A)>c(A2-),故C错误;
D.稀释相同倍数时,酸性越强,pH变化越大,则据图可知相同条件下酸性大小为:Ⅰ>Ⅱ,故D正确;
故选D.
B.设各溶液的浓度都为1mol/L,①NH4HSO4中氢离子抑制铵根离子的水解,则①中铵根离子的浓度最接近1mol/L,②(NH4 )2CO3中发生相互促进水解,由于碳酸铵的化学式中含有2个铵根离子,水解程度减小,则其溶液中铵根离子浓度大于0.1mol/L,③NH4Cl中铵根离子水解则铵根离子的浓度小于1mol/L,所以三种溶液中c(NH4+)的大小关系为:②>①>③,故B错误;
C.pH=11,则HA-的水解程度大于其电离程度,水解生成H2A,电离生成A2-,则:c(H2A)>c(A2-),故C错误;
D.稀释相同倍数时,酸性越强,pH变化越大,则据图可知相同条件下酸性大小为:Ⅰ>Ⅱ,故D正确;
故选D.
点评:本题考查了离子浓度大小比较,题目难度中等,试题涉及盐的水解原理、弱电解质的电离、酸碱混合的定性判断等知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
210℃时,5.8gCO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了1.8g,则元混合气体的平均相对分子质量为( )
| A、5.8 | B、11.6 |
| C、18.8 | D、23.2 |
下列措施不属于预防大气污染的是( )
| A、燃煤脱硫 |
| B、汽车排气系统安装净化装置 |
| C、对烟囱中的烟进行静电除尘 |
| D、植树造林,吸收污染物 |
下列对于金属的相关说法正确的是( )
| A、金属都呈银白色,易导电,易导热 |
| B、化合物中金属元素只显正价 |
| C、金属都能与氢氧化钠溶液反应 |
| D、金属都能与盐酸反应 |
下列关于金属特征的叙述正确的是( )
| A、金属原子只有还原性,离子只有氧化性 |
| B、金属元素在化合物中一定显正价 |
| C、金属元素在不同的化合物中的化合物中的化合价均不同 |
| D、金属单质在常温下均是固体 |
下列事实不能用勒沙特列原理解释的是( )
| A、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| C、实验室常用排饱和食盐水的方法收集氯气 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |