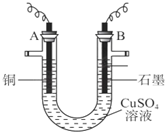
题目内容
3.下列有关化学用语表示正确的是( )| A. | 氯化钠的电子式: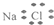 | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | NH3的电子式: | D. | S2-的结构示意图: |
分析 A.氯化钠为离子化合物,电子式中需要标出所带电荷;
B.质量数=质子数+中子数,元素符号的左上角为质量数;
C.该电子式中漏掉了N原子的一对未成键电子对;
D.硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构.
解答 解:A.离子化合物的电子式中标有电荷,氯化钠的电子式为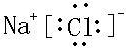 ,故A错误;
,故A错误;
B.中子数为20的氯原子的质量数为37,该原子正确的表示方法为:3717Cl,故B错误;
C.氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为 ,故C错误;
,故C错误;
D.硫离子的核外电子总数为18,最外层满足8电子稳定结构,其离子结构示意图为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、离子结构示意图、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题侧重考查学生的规范答题能力.

练习册系列答案
相关题目
13.在密闭容器中发生可逆反应CO(气)+H2O(气)?CO2(气)+H2(气)(正反应为放热反应),仅改变下列条件,不能使正反应速率增大的是( )
| A. | 升高温度 | B. | 增大密闭容器的容积 | ||
| C. | 使用催化剂 | D. | 增大压强 |
14.已知某些共价键的键能如下表所示,火箭燃料肼(N2H4)的燃烧的热化学方程式是:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-5 akJ•mol-1则O-H的键能为( )
| 共价键 | N-N | N-H | O=O | N≡N |
| 键能kJ•mol-1 | 3a | 2.5a | 4a | 8a |
| A. | 2a kJ•mol-1 | B. | 2.5a kJ•mol-1 | C. | 3a kJ•mol-1 | D. | 3.5a kJ•mol-1 |
8.有三个放热反应:
①2H2(g)+O2(g)=2H2O(g)+Q1kJ;
②2H2(g)+O2(g)=2H2O(l)+Q2kJ;
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)+Q3kJ;
其中放出热量Q1、Q2、Q3的大小关系为( )
①2H2(g)+O2(g)=2H2O(g)+Q1kJ;
②2H2(g)+O2(g)=2H2O(l)+Q2kJ;
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)+Q3kJ;
其中放出热量Q1、Q2、Q3的大小关系为( )
| A. | Q1=Q2=Q3 | B. | Q3<Q1<Q2 | C. | Q3<Q2<Q1 | D. | Q1<Q2<2Q3 |
15.有人认为人体实际上是一架缓慢燃烧着的“高级机器”,人体在生命活动过程中也需要不断补充“燃料”,按照这种观点,人们通常摄入的下列物质不能看作“燃料”的是( )
| A. | 水 | B. | 脂肪类物质 | C. | 淀粉类物质 | D. | 蛋白质 |
12.下列各组物质中,化学键类型不同的是( )
| A. | NaCl和H2O2 | B. | H2O和NH3 | C. | CaF2和CsCl | D. | CCl4和HCl |
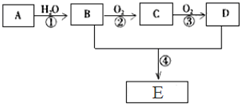 已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.
已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.