题目内容
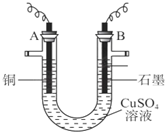
3.某研究性学习小组用电解CuSO4溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16.请回答:(1)m g应为A极的质量增重(填A或B),电解总反应的离子方程式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
(2)测定m g数据时,同学们称量电解前电极的质量,电解后,用蒸馏水小心冲洗电极,烘干后再称量电极质量.你认为在上述实验过程中,至少要称量电极3次;
(3)本实验(电解CuSO4溶液)中,学习小组采用两套方案测定铜的相对原子质量.
①第一套方案中,同学们测得气体的体积为V L(标准状况),则铜的相对原子质量是(用m、V表示)$\frac{11.2m}{V}$;
②第二套方案中,需要测定的数据是A极增加的质量和整套装置减少的质量或A极增加的质量、溶液的体积和电解后溶液的pH.
分析 (1)如果A为阳极,该装置为电镀池,阳极溶解Cu的质量与阴极析出Cu的质量相等,无法计算Cu的相对原子质量,所以A为阴极、B为阳极,Cu作阴极、石墨作阳极时,电解CuSO4溶液,阳极上氢氧根离子放电、阴极上铜离子放电,质量增加的电极为阴极,同时溶液中还生成硫酸;
(2)需要称量的有称量电解前电极的质量、电极在烘干时有两次称量;
(3)①阳极上生成氧气,根据转移电子相等计算Cu的相对原子质量;
②还可以根据析出Cu和生成氧气的关系式计算、析出Cu和生成硫酸的关系式计算
解答 解:(1)如果A为阳极,该装置为电镀池,阳极溶解Cu的质量与阴极析出Cu的质量相等,无法计算Cu的相对原子质量,所以A为阴极、B为阳极,实验中测得某电极的质量增重为m g,则应该为A极;
Cu作阴极、石墨作阳极时,电解CuSO4溶液,阳极上氢氧根离子放电、阴极上铜离子放电,质量增加的电极为阴极,同时溶液中还生成硫酸,电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:A;2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
(2)需要称量的有称量电解前电极的质量、电极在烘干时有两次称量,则需要3次称量,故答案为:3;
(3)①阳极上生成氧气,根据2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4知,氧气体积为VL时,M(Cu)=$\frac{22.4L/mol×mg}{2VL}$=$\frac{11.2m}{V}$g/mol,Cu的相对原子质量与其摩尔质量在数值上相等,所以Cu的相对原子质量为$\frac{11.2m}{V}$,故答案为:$\frac{11.2m}{V}$;
②根据2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4知,要计算Cu的相对原子质量,
还可以根据析出Cu的质量、生成氧气的质量之间的关系式计算,生成氧气的质量等于整套装置减少的质量;
还可以根据析出Cu的质量、硫酸的物质的量之间的关系式计算,要计算硫酸的物质的量,需要知道电解后溶液的体积、电解后溶液的pH(可由此计算出溶液中H+的物质的量浓度);
故答案为:A极增加的质量和整套装置减少的质量或A极增加的质量、溶液的体积和电解后溶液的pH.
点评 本题以电解原理为载体考查了实验测定Cu的相对原子质量,为高频考点,侧重考查学生分析判断及计算能力,明确各个物理量之间的关系是解本题关键,易错点是(2)题称量次数判断,题目难度不大.

| A. | 氯化钠的电子式: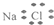 | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | NH3的电子式: | D. | S2-的结构示意图: |

下列关于该离子方程式的说法不正确的是( )
| A. | IO${\;}_{4}^{-}$作氧化剂 | |
| B. | 氧化性:Mn2+>IO${\;}_{3}^{-}$ | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 若有2mol Mn2+参加反应,则转移10mol电子 |
| A. | 12,2.5 | B. | 24,2.5 | C. | 12,3.0 | D. | 24,3.0 |
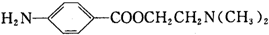 )的三条合成路线如下图所示(部分反应试剂和条件已省略):
)的三条合成路线如下图所示(部分反应试剂和条件已省略):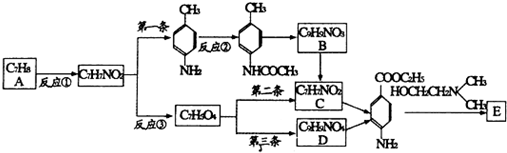
 ;C中官能团的名称是氨基和羧基.
;C中官能团的名称是氨基和羧基. ;1mol该物质与NaOH溶液共热最多消耗2mol NaOH.
;1mol该物质与NaOH溶液共热最多消耗2mol NaOH. .
.
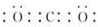 .
. .
.