题目内容
8.有三个放热反应:①2H2(g)+O2(g)=2H2O(g)+Q1kJ;
②2H2(g)+O2(g)=2H2O(l)+Q2kJ;
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)+Q3kJ;
其中放出热量Q1、Q2、Q3的大小关系为( )
| A. | Q1=Q2=Q3 | B. | Q3<Q1<Q2 | C. | Q3<Q2<Q1 | D. | Q1<Q2<2Q3 |
分析 反应放出热量越大,Q的数值越大;反应物计量数越大,放热热量越大;液态水具有能量较低,生成物为液态水时放出热量越大,据此进行判断.
解答 解:①2H2(g)+O2(g)=2H2O(g)+Q1kJ;
②2H2(g)+O2(g)=2H2O(l)+Q2kJ;
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)+Q3kJ;
反应③中计量数为①②的$\frac{1}{2}$,则反应③放出的热量最小,即Q3最小;
反应①②中,反应①生成气体水、反应②生成液态水,气体水具有能量较高,则反应②放出的热量大于反应③,即Q1<Q2,
所以放出热量Q1、Q2、Q3的大小关系为:Q3<Q1<Q2,
故选B.
点评 本题考查了反应热大小比较,题目难度不大,明确物质状态与反应热的关系为解答关键,注意掌握影响反应热的因素,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
18.铝在人体内积累可使人慢性中毒,引起老年痴呆症.世界卫生组织将铝确定为“食品污染源”之一而加以控制.铝的下列应用中无须控制的是( )
| A. | 铝制电线电缆 | B. | 铝制餐具 | C. | 铝制可乐易拉罐 | D. | 糖果内包装 |
16.元素周期表的形式多种多样,如下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法正确的是( )

| A. | ②、⑧、⑨对应简单离子半径依次减小 | |
| B. | ⑤的三种核素化学性质不同 | |
| C. | 元素=10 ⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物 |
3.下列有关化学用语表示正确的是( )
| A. | 氯化钠的电子式: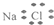 | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | NH3的电子式: | D. | S2-的结构示意图: |
17.与C6H6互为同系物的是( )
| A. | C6H5NH2 | B. | C6H5OH | C. | C6H5 CH2OH | D. | C6H5CH2 CH3 |
 ,F
,F ,AB2
,AB2 ,A的最简单气态氢化物
,A的最简单气态氢化物 .
. .
. .
.