题目内容
查阅资料得知:Na和CO2反应,产物可能有Na2CO3、Na2O、C、CO.又知CO通入PdCl2溶液中会有黑色沉淀Pd(钯)生成.有化学兴趣小组设计用下面装置(夹持装置已略去)进行“钠在CO2中燃烧”的实验,以探究这些产物是否存在.
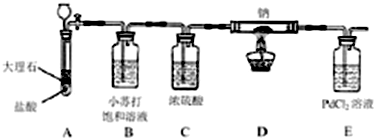
(1)简述装置A中长劲漏斗必须插入液面下的原因 .
写出装置A中发生反应的离子方程式 .
(2)依据上述实验装置进行实验,完成下表
(3)写出装置E中发生反应的化学反应方程式 .
(4)用pH试纸测②所得溶液,试纸呈蓝色,有同学得出结论:Na与CO2反应一定产生Na2O.该结论是否严谨 (选答“是”或“否”),简述理由 .

(1)简述装置A中长劲漏斗必须插入液面下的原因
写出装置A中发生反应的离子方程式
(2)依据上述实验装置进行实验,完成下表
| 序号 | 实验操作 | 实验现象 | 结论 |
| 1 | 待反应完全后,将装置D中的残留固体加蒸馏水溶解. | 有黑色不溶物 | |
| 2 | 取①所得溶液上层清液加入过量BaCl2溶液 | 产物中有Na2CO3存在 | |
| 3 | - | 产物中有CO存在 |
(4)用pH试纸测②所得溶液,试纸呈蓝色,有同学得出结论:Na与CO2反应一定产生Na2O.该结论是否严谨
考点:性质实验方案的设计
专题:实验设计题
分析:(1)根据长颈漏斗的特点以及实验目的来回答;碳酸钙可以和盐酸发生反应生成二氧化碳气体;
(2)根据物质的性质:碳是黑色固体、碳酸根离子可以和氯化钡反应、一氧化碳可以和PdCl2溶液反应来进行回答;
(3)根据信息:CO通入PdCl2溶液中会有黑色沉淀Pd(钯)生成来书写方程式;
(4)金属钠可以和空气中的氧气发生反应生成氧化钠,根据装置的特点来回答.
(2)根据物质的性质:碳是黑色固体、碳酸根离子可以和氯化钡反应、一氧化碳可以和PdCl2溶液反应来进行回答;
(3)根据信息:CO通入PdCl2溶液中会有黑色沉淀Pd(钯)生成来书写方程式;
(4)金属钠可以和空气中的氧气发生反应生成氧化钠,根据装置的特点来回答.
解答:
解:(1)长颈漏斗如果不伸入液面以下,则产生的气体会沿着长颈漏斗泄露,深入压面以下还便于控制气体的产生,碳酸钙可以和盐酸发生反应生成二氧化碳气体:CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:防止产生的气体泄露,便于控制气体的产生;CaCO3+2H+=Ca2++H2O+CO2↑;
(2)金属钠在二氧化碳中燃烧,产物可以是碳、碳酸钠、氧化钠等,待反应完全后,将装置D中的残留固体加蒸馏水溶解,若有黑色固体出现,则黑色固体是碳单质,碳酸根离子可以和氯化钡反应生成碳酸钡白色沉淀,取①所得溶液上层清液加入过量BaCl2溶液,出现白色沉淀可以证明碳酸钠的存在,根据一氧化碳可以和PdCl2溶液反应有黑色沉淀Pd生成,可以证明产物中有一氧化碳,故答案为:产物中存在有碳;有白色沉淀生成;装置E中出现黑色沉淀;
(3)CO通入PdCl2溶液中会有黑色沉淀Pd(钯)生成,即CO+PdCl2+H2O=Pd↓+2HCl+CO2,故答案为:CO+PdCl2+H2O=Pd↓+2HCl+CO2;
(4)用pH试纸测②所得溶液,试纸呈蓝色,可以证明产物中有固体氧化钠,氧化钠的水溶液氢氧化钠显示碱性,但是由于金属钠可以和空气中的氧气发生反应生成氧化钠,不能排除该套实验装置中可能存在空气的可能,所以不能得出结论:Na与CO2反应一定产生Na2O,故答案为:否;该套实验装置中可能存在空气.
(2)金属钠在二氧化碳中燃烧,产物可以是碳、碳酸钠、氧化钠等,待反应完全后,将装置D中的残留固体加蒸馏水溶解,若有黑色固体出现,则黑色固体是碳单质,碳酸根离子可以和氯化钡反应生成碳酸钡白色沉淀,取①所得溶液上层清液加入过量BaCl2溶液,出现白色沉淀可以证明碳酸钠的存在,根据一氧化碳可以和PdCl2溶液反应有黑色沉淀Pd生成,可以证明产物中有一氧化碳,故答案为:产物中存在有碳;有白色沉淀生成;装置E中出现黑色沉淀;
(3)CO通入PdCl2溶液中会有黑色沉淀Pd(钯)生成,即CO+PdCl2+H2O=Pd↓+2HCl+CO2,故答案为:CO+PdCl2+H2O=Pd↓+2HCl+CO2;
(4)用pH试纸测②所得溶液,试纸呈蓝色,可以证明产物中有固体氧化钠,氧化钠的水溶液氢氧化钠显示碱性,但是由于金属钠可以和空气中的氧气发生反应生成氧化钠,不能排除该套实验装置中可能存在空气的可能,所以不能得出结论:Na与CO2反应一定产生Na2O,故答案为:否;该套实验装置中可能存在空气.
点评:本题考查学生金属钠和二氧化碳的反应产物的探究,有助于学生能力的考查,必须活学活用才能解好这类有新意的试题.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
下列有关实验原理或实验操作正确的是( )
A、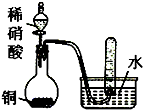 验证铜与稀硝酸的反应产物是NO |
B、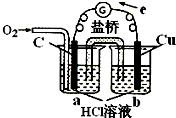 实现化学反应:2Cu+O2+4H+=2Cu2++2H2O |
C、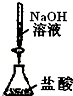 测定盐酸的浓度 |
D、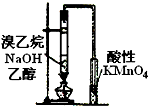 检验溴乙烷与NaOH醇溶液共热有乙烯生成 |
分离下列三组混合物依次采取的方法正确的是:①植物油和氯化钠溶液 ②碳酸钙和氯化钙的水溶液 ⑧氯化钠和碘( )
| A、分液、蒸馏、萃取 |
| B、蒸发、过滤、分液 |
| C、分液、过滤、加热升华 |
| D、蒸馏、萃取、分液 |
将铁的化合物溶于盐酸,滴加KSCN溶液,不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
| A、Fe2O3 |
| B、FeCl3 |
| C、Fe2(SO4)3 |
| D、FeO |
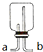 可连接在E处,则Cl2从
可连接在E处,则Cl2从