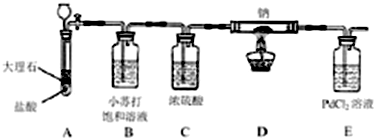
题目内容
下列有关实验原理或实验操作正确的是( )
A、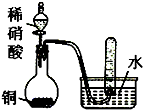 验证铜与稀硝酸的反应产物是NO |
B、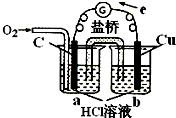 实现化学反应:2Cu+O2+4H+=2Cu2++2H2O |
C、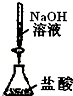 测定盐酸的浓度 |
D、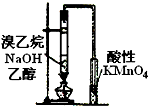 检验溴乙烷与NaOH醇溶液共热有乙烯生成 |
考点:化学实验方案的评价
专题:
分析:A.装置中有空气,生成的NO易被氧化生成二氧化氮;
B.通入氧气的一极为原电池的正极,铜可被氧化,为原电池的负极;
C.氢氧化钠应放在碱性滴定管;
D.不能排除乙醇的影响.
B.通入氧气的一极为原电池的正极,铜可被氧化,为原电池的负极;
C.氢氧化钠应放在碱性滴定管;
D.不能排除乙醇的影响.
解答:
解:A.装置中有空气,生成的NO易被氧化生成二氧化氮,应先排除装置内的空气,故A错误;
B.通入氧气的一极为原电池的正极,铜可被氧化,为原电池的负极,为铜的吸氧腐蚀,反应为2Cu+O2+4H+=2Cu2++2H2O,故B正确;
C.氢氧化钠可腐蚀玻璃塞,应放在碱性滴定管,故C错误;
D.乙醇易挥发,生成的乙烯中含有乙醇,乙醇可与酸性高锰酸钾发生氧化还原反应,故D错误.
故选B.
B.通入氧气的一极为原电池的正极,铜可被氧化,为原电池的负极,为铜的吸氧腐蚀,反应为2Cu+O2+4H+=2Cu2++2H2O,故B正确;
C.氢氧化钠可腐蚀玻璃塞,应放在碱性滴定管,故C错误;
D.乙醇易挥发,生成的乙烯中含有乙醇,乙醇可与酸性高锰酸钾发生氧化还原反应,故D错误.
故选B.
点评:本题考查较为综合,涉及气体的检验、金属的腐蚀、中和滴定以及乙烯的制备等,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力和评价能力的考查,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难道不大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
| A、HCl |
| B、K2SO4 |
| C、FeCl3 |
| D、NaCl |
某白色固体由Na2CO3、NaOH及Na2CO3?nH2O组成,取该固体10g加入到100mL1mol/L的硫酸,恰好使其完全产生气体896mL(标况)的气体,将剩余的溶液蒸干可以得到的固体质量为( )
| A、14.2g | B、4.24g |
| C、11.44 | D、无法计算 |
将气体A2和B2各1mol注入容积为1L的密闭容器中反应生成C,平衡时测得c(A2)=0.58mol/L,则c(B2)=0.16mol/L,c(C)=0.84mol/L,则C的分子式为( )
| A、AB2 |
| B、A2B4 |
| C、AB |
| D、A2B |
做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:2MnO4-+5C2O42-+H+C2O4-CO2MnO4-+Mn2++□.关于此反应的叙述正确的是( )
| A、该反应的氧化剂是MnO4- |
| B、该反应右边方框内的产物是OH- |
| C、该反应电子转移总数是5e- |
| D、配平该反应后,H+的系数是16 |
可逆反应A(g)+B?C(g)+D,达到平衡时,下列说法不正确的是( )
| A、若B是气体,增大A的浓度会使B转化率增大 |
| B、若增大A的浓度,平衡体系颜色加深,D不一定是有颜色的气体 |
| C、升高温度,C百分含量减少,说明正反应是放热反应 |
| D、增大压强,平衡不移动,说明B、D是气体 |