题目内容
(1)常温时向水中加入少量固体MgCl2, (填“促进”或“抑制”)了水的电离;与纯水相比,所得溶液中KW (填“变大”、“变小”或“不变”).
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种:
A、c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B、c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C、c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D、c(Cl-)>c(H+)>c(NH4+)>c(OH-)
①上述关系一定不正确的是 (填序号).
②若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为 (填序号).
③若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显 (填“酸性”、“碱性”或“中性”).
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种:
A、c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B、c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C、c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D、c(Cl-)>c(H+)>c(NH4+)>c(OH-)
①上述关系一定不正确的是
②若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为
③若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显
考点:离子浓度大小的比较,盐类水解的原理
专题:
分析:(1)MgCl2是强酸弱碱盐,镁离子水解导致溶液呈酸性,温度不变,水的离子积常数不变;
(2)①任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
②若溶液中只有一种溶质,为NH4Cl,溶液呈酸性,c(H+)>c(OH-),但水解程度很小;
③若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒判断c(H+)、c(OH-)相对大小.
(2)①任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
②若溶液中只有一种溶质,为NH4Cl,溶液呈酸性,c(H+)>c(OH-),但水解程度很小;
③若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒判断c(H+)、c(OH-)相对大小.
解答:
解:(1)MgCl2是强酸弱碱盐,镁离子水解导致溶液呈酸性,从而促进水的电离;温度不变,水的离子积常数不变,故答案为:促进;不变;
(2)①任何电解质溶液中都存在电荷守恒,如果c(OH-)>c(H+),根据电荷守恒得c(Cl-)<c(NH4+),故B错误,故选B;
②若溶液中只有一种溶质,为NH4Cl,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒得c(Cl-)>c(NH4+),但水解程度很小,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故选A;
③若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒得c(H+)=c(OH-),溶液呈中性,故答案为:中性.
(2)①任何电解质溶液中都存在电荷守恒,如果c(OH-)>c(H+),根据电荷守恒得c(Cl-)<c(NH4+),故B错误,故选B;
②若溶液中只有一种溶质,为NH4Cl,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒得c(Cl-)>c(NH4+),但水解程度很小,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故选A;
③若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒得c(H+)=c(OH-),溶液呈中性,故答案为:中性.
点评:本题考查离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,根据溶液酸碱性确定其它离子浓度相对大小,侧重考查学生分析问题、解答问题能力,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
| A、HCl |
| B、K2SO4 |
| C、FeCl3 |
| D、NaCl |
做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:2MnO4-+5C2O42-+H+C2O4-CO2MnO4-+Mn2++□.关于此反应的叙述正确的是( )
| A、该反应的氧化剂是MnO4- |
| B、该反应右边方框内的产物是OH- |
| C、该反应电子转移总数是5e- |
| D、配平该反应后,H+的系数是16 |
已知图一表示的是可逆反应CO(g)+H2(g)?C(s)+H2O(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)?N2O4(g)△H<0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
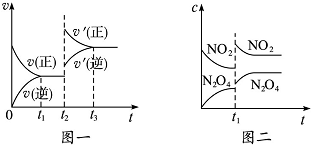

| A、图一t2时改变的条件可能是升高了温度或增大了压强 |
| B、图一t2时改变的条件一定是增大了反应物的浓度 |
| C、图二t1时改变的条件可能是升高了温度或增大了压强 |
| D、若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
可逆反应A(g)+B?C(g)+D,达到平衡时,下列说法不正确的是( )
| A、若B是气体,增大A的浓度会使B转化率增大 |
| B、若增大A的浓度,平衡体系颜色加深,D不一定是有颜色的气体 |
| C、升高温度,C百分含量减少,说明正反应是放热反应 |
| D、增大压强,平衡不移动,说明B、D是气体 |
已知:①1mol H2 分子中化学键断裂时需要吸收 436kJ 的能量②1mol Cl2 分子中化学键断裂时需要吸收 243kJ 的能量③由 H 原子和 Cl 原子形成 1mol HCl 分子时释放 431kJ 的能量.则下列叙述正确的是( )
| A、氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g)=2HCl(g) |
| B、氢气和氯气反应生成 2mol 氯化氢气体,反应的△H=183kJ/mol |
| C、氢气和氯气反应生成 2mol 氯化氢气体,反应的△H=-183kJ/mol |
| D、氢气和氯气反应生成 1mol 氯化氢气体,反应的△H=-183kJ/mol |