题目内容
将铁的化合物溶于盐酸,滴加KSCN溶液,不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
| A、Fe2O3 |
| B、FeCl3 |
| C、Fe2(SO4)3 |
| D、FeO |
考点:氯气的化学性质,铁的化学性质,铁的氧化物和氢氧化物
专题:元素及其化合物
分析:将铁的化合物X溶于盐酸,滴加硫氰化钾溶液不发生颜色变化,则不含三价铁,再加入适量氯水,溶液立即呈红色,说明原物质中含有+2价铁,以此来解答.
解答:
解:滴加硫氰化钾溶液没有颜色变化,说明溶液中没有三价铁离子,Fe2O3、FeCl3、Fe2(SO4)3溶于盐酸,溶液中滴加KSCN都呈红色,虽然氧化亚铁和稀盐酸反应生成的氯化亚铁溶液中虽然没有铁离子,但加入氯水后,氯水具有很强的氧化性,会把亚铁离子氧化成铁离子,遇硫氰酸钾变红,
故选D.
故选D.
点评:本题考查了铁及其化合物的有关的化学性质,为高频考点,侧重于三价铁离子的检验方法,培养灵活应用知识的能力,难度不大.

练习册系列答案
相关题目
将气体A2和B2各1mol注入容积为1L的密闭容器中反应生成C,平衡时测得c(A2)=0.58mol/L,则c(B2)=0.16mol/L,c(C)=0.84mol/L,则C的分子式为( )
| A、AB2 |
| B、A2B4 |
| C、AB |
| D、A2B |
存放下列试剂的方法中,有错误并且会引起危险的是( )
| A、白磷浸在盛有CS2的敞口试剂瓶中 |
| B、金属钠浸在盛有煤油的试剂瓶中 |
| C、浓硝酸存放在棕色试剂瓶中 |
| D、溴水放在带玻璃塞的试剂瓶中 |
做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:2MnO4-+5C2O42-+H+C2O4-CO2MnO4-+Mn2++□.关于此反应的叙述正确的是( )
| A、该反应的氧化剂是MnO4- |
| B、该反应右边方框内的产物是OH- |
| C、该反应电子转移总数是5e- |
| D、配平该反应后,H+的系数是16 |
已知图一表示的是可逆反应CO(g)+H2(g)?C(s)+H2O(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)?N2O4(g)△H<0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
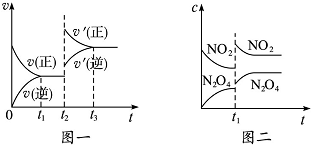

| A、图一t2时改变的条件可能是升高了温度或增大了压强 |
| B、图一t2时改变的条件一定是增大了反应物的浓度 |
| C、图二t1时改变的条件可能是升高了温度或增大了压强 |
| D、若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
下列有关实验的叙述正确的是( )
| A、重结晶提纯KNO3产品除去NaCl时,应在较高温度下溶解产品配成浓溶液后冷却结晶 |
| B、用移液管移取溶液后放入锥形瓶中时,移液管下端不能接触到瓶壁 |
| C、拆卸加热装置、并有导管伸入液体中的,应先停止加热,再将导管取出液面 |
| D、用排水法收集气体时,应将导管伸入集气瓶底部 |