题目内容
20.工业制硫酸中的一步重要反应是2SO2+O2$?_{加热}^{催化剂}$2SO3,这是一个正反应放热的可逆反应.下列说法正确的是( )| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 向该体系中充入18O2,一段时间后18O只存在于SO3中 | |
| C. | 生成物的总能量大于反应物的总能量 | |
| D. | 将该反应设计成原电池,放出的热量不变 |
分析 A、使用催化剂加快了反应速率,缩短反应时间,提高反应效率,平衡不移动;
B、根据可逆反应的特征分析;
C、正反应是放热反应;
D、若把该反应设计成原电池,化学能除转化成热能外,还转化成电能,所以放出的热量应减少.
解答 解:A、使用催化剂加快了反应速率,缩短反应时间,提高反应效率,平衡不移动,提高反应效率,平衡不移动,故A正确;
B、由于反应为可逆反应,在达到平衡的体系中,充入由18O原子组成的O2后,SO2、O2、SO3中18O都出现,故B错误;
C、正反应是放热反应,则生成物的总能量小于反应物的总能量,故C错误;
D、若把该反应设计成原电池,化学能除转化成热能外,还转化成电能,所以放出的热量应减少,故D错误;
故选A.
点评 本题考查了可逆反应和平衡的移动等知识点,难度不大,注意可逆反应不可能完全转化,放热反应是反应物的总能量高于生成物的总能量.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
10.室温下,将0.1molK2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质.有关结论正确的是( )
| 加入的物质 | 结论 | |
| A | 100mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| B | 0.01molK2O | 溶液中$\frac{c(HC{{O}_{3}}^{-})}{c(O{H}^{-})}$ 增大 |
| C | 50mL 1mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| D | 0.1molKHSO4固体 | 反应结束后,溶液pH=7 |
| A. | A | B. | B | C. | C | D. | D |
11.下列说法不正确的是( )
| A. | 反应是放热还是吸热必须看生成物和反应物所具有的总能量的相对大小 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能储存起来 | |
| C. | 吸热反应都要加热才能进行 | |
| D. | 物质的化学能可以在一定条件下转化为热能、电能为人类所利用 |
8.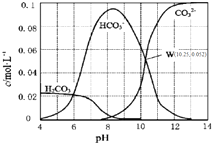 25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
 25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )| A. | 在pH=7.0时,溶液中含碳粒子只有CO32-和HCO3- | |
| B. | 向Na2CO3溶液中通入HCl气体,立即产生CO2气体 | |
| C. | H2CO3的Ka2=1.0×10-10.25 | |
| D. | 向100 mL 0.1 mol•L-1碳酸钠溶液中滴加盐酸至溶液pH=4.0,生成CO2气体224 mL |
12.在一定温度下,Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-.下列说法中,正确的是( )
| A. | n(Na+)+n(H+)=n(HCO3-)+n(CO32-)+n(OH-) | |
| B. | 通入CO2,平衡向正反应方向移动 | |
| C. | 加入少量的NaOH固体,平衡向逆反应方向移动,溶液pH减小 | |
| D. | 稀释溶液,Na2CO3水解程度增大,水解平衡常数增大 |
9.用下列装置能达到有关实验目的是( )


| A. | 图1装置可以用来电解制氢气和氯气 | |
| B. | 图2装置可以完成“喷泉”实验 | |
| C. | 图3装置可以用来实验室制氯气 | |
| D. | 图4装置可以用来配制一定物质的量浓度的氯化钠溶液 |
10.下列离子的检验方法和结论正确的是( )
| A. | 向某溶液中滴加几滴双氧水后再滴加2滴KSCN溶液,溶液变成血红色,则原溶液中一定含有Fe2+ | |
| B. | 向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀,则原溶液中一定含有SO42- | |
| C. | 向某溶液中加入稀盐酸产生无色气体,产生的气体使澄清石灰水变浑浊,则原溶液中一定有CO32- | |
| D. | 向某溶液中滴加NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液中一定含 有NH4+ |

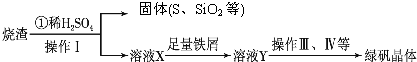
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.