题目内容
10.室温下,将0.1molK2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质.有关结论正确的是( )| 加入的物质 | 结论 | |
| A | 100mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| B | 0.01molK2O | 溶液中$\frac{c(HC{{O}_{3}}^{-})}{c(O{H}^{-})}$ 增大 |
| C | 50mL 1mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| D | 0.1molKHSO4固体 | 反应结束后,溶液pH=7 |
| A. | A | B. | B | C. | C | D. | D |
分析 n(K2CO3)=0.05mol,碳酸钾是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,水解方程式为CO32-+H2O?HCO3-+OH-,
A.加水碳酸钾的浓度减小,溶液的碱性减小;
B.K2O与水反应生成KOH,溶液中氢氧根离子浓度增大;
C.0.1molK2CO3中钾离子为0.2mol,50mL1mol/LH2SO4中硫酸根离子为0.05mol;
D.KHSO4和K2CO3反应方程式为:2KHSO4+K2CO3=K2SO4+H2O+CO2↑,根据方程式知,二者恰好反应生成K2SO4、H2O、CO2,溶液中的溶质是硫酸钾.
解答 解:n(Na2CO3)=0.05mol,碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,水解方程式为CO32-+H2O?HCO3-+OH-,
A.加水碳酸钾的浓度减小,溶液的碱性减小,水的电离程度减小,所以水电离的氢氧根离子和氢离子浓度减小,所以由水电离出的c(H+)•c(OH-)减小,故A错误;
B.K2O与水反应生成KOH,溶液中氢氧根离子浓度增大,抑制了K2CO3的水解,所以溶液中$\frac{c(HC{{O}_{3}}^{-})}{c(O{H}^{-})}$ 减小,故B错误;
C.0.1molK2CO3中钾离子为0.2mol,50mL1mol/LH2SO4中硫酸根离子为0.05mol,所以溶液中(K+)=4c(SO42-),故C错误;
D.KHSO4和K2CO3反应方程式为:2KHSO4+K2CO3=K2SO4+H2O+CO2↑,根据方程式知,二者恰好反应生成K2SO4、H2O、CO2,溶液中的溶质是硫酸钾,溶液呈中性,溶液pH=7,故D正确;
故选D.
点评 本题考查离子浓度大小比较,明确盐类水解原理及物质之间的反应是解本题关键,结合电荷守恒、盐类水解特点分析解答,易错选项是A,注意A中计算的是水电离出的c(H+).c(OH-)之积而不是溶液中c(H+).c(OH-)之积,为易错点.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案| A. | 铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| B. | 铝制品由于表面有致密的氧化膜,可以稳定存在于空气中 | |
| C. | 苹果放在空气中久置变黄和漂白过纸张久置变黄原理相似 | |
| D. | 高纯度的SiO2对光有很好的折射和全反射作用,可以制成光电池将光能直接转化为电能 |
| A. | 铝钠合金的熔点比铝低 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 | |
| D. | m g不同组成的铝钠合金投入足量盐酸中,放出的H 2 越多,则铝的质量分数越小 |
| A. | 稳定性:Na2CO3>NaHCO3 | B. | 熔点:生铁>纯铁 | ||
| C. | 酸性:H2CO3>HClO | D. | 氧化性:Fe3+>Cu2+ |
| A. | 氯化硼是原子晶体 | |
| B. | 熔化时,氯化硼能导电 | |
| C. | 硼原子以sp3杂化 | |
| D. | 水解方程式:BCl3+3H2O═H3BO3+3HCl |
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 向该体系中充入18O2,一段时间后18O只存在于SO3中 | |
| C. | 生成物的总能量大于反应物的总能量 | |
| D. | 将该反应设计成原电池,放出的热量不变 |
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: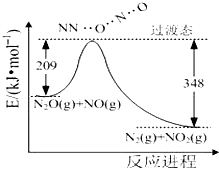 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题: