题目内容
6.氮、氧、磷、铁是与生命活动密切相关的元素.回答下列问题(1)P的基态原子最外电子层具有的原子轨道数为9,Fe3+比Fe2+稳定的原因是Fe3+的价电子排布式为3d5,处于半充满状态,结构稳定.
(2)N、O、P三种元素第一电离能最大的是N,电负性最大的是O.
(3)含氮化合物NH4SCN溶液是检验Fe3+的常用试剂,SCN-中C原子的杂化类型为sp,1mol的SCN-中含π键的数目为2NA.
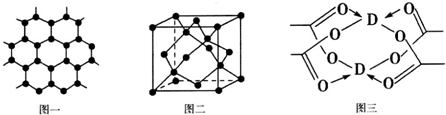
(4)某直链多磷酸钠的阴离子呈如图1所示的无限单链状结构,其中磷氧四面体通过共用顶点的氧原子相连,则该多磷酸钠的化学式为NaPO3.

(5)FeO、NiO的晶体结构均与NaCl晶体结构相同,其中Fe2+与Ni2+的离子半径分别为7.8×10-2nm、6.9×10-2nm,则熔点FeO<NiO(填“<”、“>”或“=”),原因是FeO和NiO相比,阴离子相同,阳离子所带电荷相同,但亚铁离子半径大于镍离子,所以FeO晶格能小,熔点低.
(6)磷化硼是一种超硬耐磨的涂层材料,其晶胞如图2所示.P原子与B原子的最近距离为a cm,则磷化硼晶胞的边长为$\frac{4a}{\sqrt{3}}$cm.(用含a的代数式表示)
分析 (1)P的基态原子最外电子层具有的原子轨道为1个1s、1个2s、3个2p、1个3s、3个3p;轨道中电子处于半满、全满、全空时该微粒最稳定;
(2)同一周期元素,元素的电负性随着原子序数增大而增大,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,同一主族元素第一电离能、电负性随着原子序数增大而减小;
(3)含氮化合物NH4SCN溶液是检验Fe3+的常用试剂,SCN-中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互称理论判断C原子的杂化类型,1个SCN-中π键个数为2;
(4)由链状结构可知每个P与3个O形成阴离子,且P的化合价为+5价,以此判断形成的化合物的化学式;
(5)离子晶体熔沸点与晶格能成正比,晶格能与离子比较成反比、与电荷成正比;
(6)原子与B原子的最近距离为a cm,为晶胞体长的$\frac{1}{4}$,晶胞体长等于棱长的$\sqrt{3}$倍.
解答 解:(1)P的基态原子最外电子层具有的原子轨道为1个1s、1个2s、3个2p、1个3s、3个3p,则P的基态原子最外电子层具有的原子轨道数=1+1+3+1+3=9;轨道中电子处于半满、全满、全空时该微粒最稳定,Fe3+的价电子排布式为3d5,处于半充满状态,结构稳定,
故答案为:9;Fe3+的价电子排布式为3d5,处于半充满状态,结构稳定;
(2)同一周期元素,元素的电负性随着原子序数增大而增大,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,同一主族元素第一电离能、电负性随着原子序数增大而减小,
所以第一电离能大小顺序是N>O>P,电负性大小顺序是O>N>P,
故答案为:N;O;
(3)含氮化合物NH4SCN溶液是检验Fe3+的常用试剂,SCN-中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互称理论判断C原子的杂化类型为sp,1个SCN-中π键个数为2,则1mol的SCN-中含π键的数目为2NA,故答案为:sp;2;
(4)由链状结构可知每个P与3个O形成阴离子,且P的化合价为+5价,则形成的化合物化学式为NaPO3,故答案为:NaPO3;
(5)离子晶体熔沸点与晶格能成正比,晶格能与离子比较成反比、与电荷成正比,FeO和NiO相比,阴离子相同,阳离子所带电荷相同,但亚铁离子半径大于镍离子,所以FeO晶格能小,熔点低,
故答案为:<;FeO和NiO相比,阴离子相同,阳离子所带电荷相同,但亚铁离子半径大于镍离子,所以FeO晶格能小,熔点低;
(6)原子与B原子的最近距离为a cm,为晶胞体长的$\frac{1}{4}$,晶胞体长等于棱长的$\sqrt{3}$倍,则晶胞棱长=$\frac{\frac{acm}{\frac{1}{4}}}{\sqrt{3}}$cm=$\frac{4a}{\sqrt{3}}$cm,
故答案为:$\frac{4a}{\sqrt{3}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、晶体熔沸点高低判断、元素周期律及原子核外电子排布等知识点,侧重考查学生分析判断、计算及空间想象能力,熟练掌握价层电子对互称理论、元素周期律、均摊法等基本理论是解本题关键,注意(6)中P原子与B原子的最近距离与晶胞体长的关系,为易错点.

| A. | 酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2-3次 | |
| B. | 可使用酚酞或甲基橙作指示剂 | |
| C. | 滴定过程中眼睛应始终注视滴定管内液面变化 | |
| D. | 读取标准溶液的刻度时,滴定前平视,滴定后仰视,测定结果偏高 |
I.由乙二醛催化氧化制乙醛酸的反应如下:
2OHC-CHO(g)+O2(g)?2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表:
| 化学键 | O=O | C-O | O-H | C-H |
| 键能(kJ•mol-1) | 498 | 351 | 465 | 413 |
(2)一定条件下,按照$\frac{n({O}_{2})}{n(OHC-CHO)}$=$\frac{1}{2}$投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图1所示.
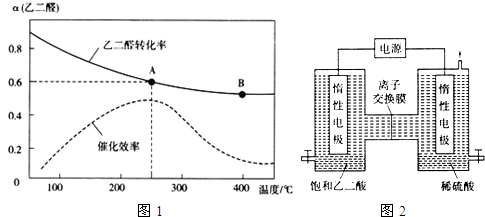
①该反应在A点放出的热量>(填“>”、“=”或“<”)B点放出的热量.
②某同学据图推知,生成乙醛酸的速率:v(A)>v(B),你认为此结论是否正确,简述理由.不正确,温度越高,催化效率越高,化学反应速率越快,而A点的温度低、催化效率高,B点的温度高、催化效率低,所以无法比较速率大小
③图中A点时,乙醛酸的体积分数为50%.
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有增大压强或及时分离出乙醛酸(列举一条).
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如图2所示.
(1)图中的离子交换膜为阳(填“阳”或“阴”)膜.
(2)稀硫酸的作用为提供氢离子,作电解质溶液.
(3)生成乙醛酸的电极反应式为HOOC-COOH+2H++2e-→OHC-COOH+H2O.
| A. | 同质量、不同密度的N2和CO | B. | 同密度、同体积的H2和N2 | ||
| C. | 同体积、同密度的C2H4和C3H6 | D. | 同温度、同体积的N2O和CO2 |
| A. | F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应 | |
| B. | H2O在4000℃以上开始明显分解,H2S用酒精灯加热即可完全分解 | |
| C. | 氯与钠形成离子键,氯与硅形成共价键 | |
| D. | “NO2球”在冷水中颜色变浅,在热水中颜色加深 |
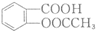 和
和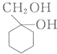 的流程路线.
的流程路线.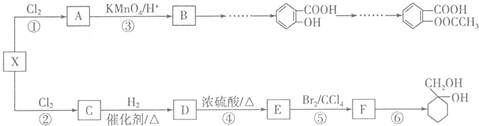
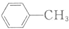 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$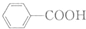
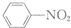 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$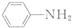 (苯胺,易被氧化)
(苯胺,易被氧化)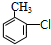 .
. .
.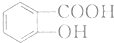 有多种同分异构体,写出符合下列条件的同分异构体的结构简式
有多种同分异构体,写出符合下列条件的同分异构体的结构简式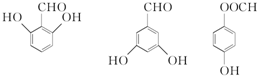 (任写一种).
(任写一种).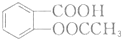 的结构与性质,说法正确的是AD.
的结构与性质,说法正确的是AD.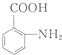 最合理的方案,请在答题纸的方框中表示.
最合理的方案,请在答题纸的方框中表示.