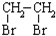题目内容
13.如图所示是工业生产硝酸铵的流程.
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:N2+3H2$?_{△}^{铁}$2NH3.
(2)B装置中Pt-Rh合金网的作用是催化剂,写出B中有关反应方程式:4NH3+5O2$\frac{\underline{\;Pt-Rh合金网\;}}{△}$4NO+6H2O.
(3)写出D中反应方程式:NH3+HNO3=NH4NO3.
(4)A、B、C、D四个容器中的反应,属于氧化还原反应的是ABC(填字母).
分析 从流程图可知,N2和H2在红热铁砂网的催化作用下合成氨气,氨气和空气中的O2在铂铑合金网的催化作用下发生催化氧化生成NO和H2O,将NO和空气、水混合,NO和O2和水反应生成HNO3,然后NH3和HNO3反应生成NH4NO3,据此分析.
解答 解:(1)N2和H2在红热铁砂网的催化作用下合成氨气,化学方程式为:N2+3H2$?_{△}^{铁}$2NH3,故答案为:N2+3H2$?_{△}^{铁}$2NH3;
(2)B装置中在的催化作用下,氨气和氧气发生催化氧化反应,B装置中在Pt-Rh合金网的催化作用下,氨气和氧气发生催化氧化反应生成NO和H2O,化学方程式为:4NH3+5O2$\frac{\underline{\;Pt-Rh合金网\;}}{△}$4NO+6H2O,
故答案为:催化剂;4NH3+5O2$\frac{\underline{\;Pt-Rh合金网\;}}{△}$4NO+6H2O;
(3)在D中,NH3和HNO3反应生成NH4NO3,故化学方程式为:NH3+HNO3=NH4NO3,故答案为:NH3+HNO3=NH4NO3;
(4)题中涉及的化学反应有:①N2+3H2$?_{△}^{铁}$2NH3②4NH3+5O2$\frac{\underline{\;Pt-Rh合金网\;}}{△}$4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3,其中①②③④⑤属于氧化还原反应,即ABC属于氧化还原反应,
故答案为:ABC.
点评 本题考查了热化学方程式的意义,明确工业合成氨为可逆反应,熟悉常见的反应的书写是解题关键,题目难度不大.

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案将5.4 g Al投入200.0 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为( )
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
| A. | W、X、Y、Z原子的核外最外层电子数的总和为19 | |
| B. | W的阴离子半径小于Li+ | |
| C. | W与Y可形成既含离子键又含共价键的化合物 | |
| D. | X、Y的简单气态氢化物的稳定性:X>Y |
I.由乙二醛催化氧化制乙醛酸的反应如下:
2OHC-CHO(g)+O2(g)?2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表:
| 化学键 | O=O | C-O | O-H | C-H |
| 键能(kJ•mol-1) | 498 | 351 | 465 | 413 |
(2)一定条件下,按照$\frac{n({O}_{2})}{n(OHC-CHO)}$=$\frac{1}{2}$投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图1所示.
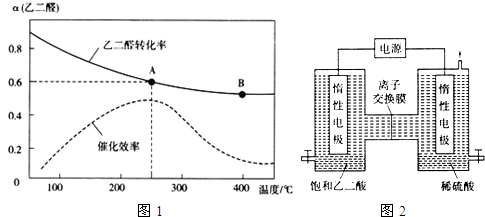
①该反应在A点放出的热量>(填“>”、“=”或“<”)B点放出的热量.
②某同学据图推知,生成乙醛酸的速率:v(A)>v(B),你认为此结论是否正确,简述理由.不正确,温度越高,催化效率越高,化学反应速率越快,而A点的温度低、催化效率高,B点的温度高、催化效率低,所以无法比较速率大小
③图中A点时,乙醛酸的体积分数为50%.
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有增大压强或及时分离出乙醛酸(列举一条).
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如图2所示.
(1)图中的离子交换膜为阳(填“阳”或“阴”)膜.
(2)稀硫酸的作用为提供氢离子,作电解质溶液.
(3)生成乙醛酸的电极反应式为HOOC-COOH+2H++2e-→OHC-COOH+H2O.
| 选项 | 离子 | 要求 |
| A | K+、Cl-、SO42-、MnO4- | c(K+)<c(Cl-) |
| B | Na+、Ca2+、I-、NO3- | c(H+)/c(OH-)=1×1014 |
| C | Al3+、NH4+、SO42-、CH3COO- | 滴加NaOH溶液立刻有气体产生 |
| D | Na+、Mg2+、Ag+、NO3- | 滴加氨水先有沉淀产生,后沉淀部分溶解 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 食品包装内常放置具有吸水性的化学药品以保持干燥,如五氧化二磷和硅胶 | |
| B. | 青蒿素在超临界CO2中有很强的溶解性,萃取青蒿素可用超临界CO2作萃取剂 | |
| C. | 利用太阳能电池板发电,不发生化学变化 | |
| D. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
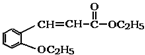 )是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,E为中间产物(结构简式为
)是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,E为中间产物(结构简式为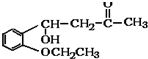 )其合成路线如图:
)其合成路线如图:
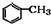 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$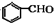
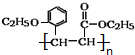 .
.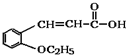 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$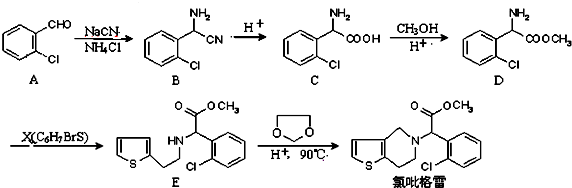
 .
. .
.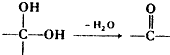
 中氯原子较难水解
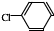
中氯原子较难水解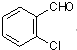 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 、
、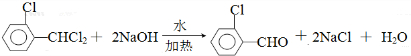 .该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式
.该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式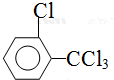 、
、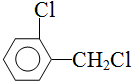 .
.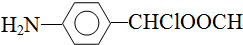 .
.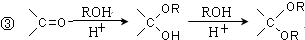
 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: