题目内容
18.现有4.9gMgO、Mg(OH)2的固体混合物,与l00g9.8%的稀H2SO4恰好完全反应,形成不饱和溶液.则原固体混合物中镁元素的质量为( )| A. | 1.2g | B. | 1.6g | C. | 2.4g | D. | 4.8g |
分析 与l00g9.8%的稀H2SO4恰好完全反应,生成MgSO4,结合Mg原子守恒计算.
解答 解:与l00g9.8%的稀H2SO4恰好完全反应,生成MgSO4,n(H2SO4)=$\frac{100g×9.8%}{98g/mol}$=0.1mol,由Mg~H2SO4~MgSO4可知,混合物中n(Mg)=0.1mol,
则原固体混合物中镁元素的质量为0.1mol×24g/mol=2.4g,
故选C.
点评 本题考查混合物的计算,为高频考点,把握发生的反应、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列物质能与SO2气体起反应,但无沉淀产生的是( )
①溴水 ②Ba(OH)2溶液 ③石灰水 ④Na2CO3⑤稀H2SO4 ⑥Na2SO4 ⑦Na2SO3.
①溴水 ②Ba(OH)2溶液 ③石灰水 ④Na2CO3⑤稀H2SO4 ⑥Na2SO4 ⑦Na2SO3.
| A. | 只有① | B. | ①④⑤ | C. | ④⑥⑦ | D. | ①④⑦ |
3.由甲酸甲酯、葡萄糖、乙醛、丙酸四种物质组成的混合物,已知其中氧元素的质量分数为37%,则氢元素的质量分数为( )
| A. | 9% | B. | 12% | C. | 16% | D. | 21% |
10.下列关于电池的说法正确的是( )
| A. | 原电池负极金属一定比正极金属的金属性活泼 | |
| B. | 原电池中电解质溶液中的阳离子向负极移动 | |
| C. | 碱性锌猛锰干电池的负极反应为:Zn-2e-+4OH-=ZnO22-+2H2O | |
| D. | 铅蓄电池工作时转移电子数为2NA时,负极材料质量减少207g |
7.用下列实验装置进行相应实验,能达到实验目的是( )
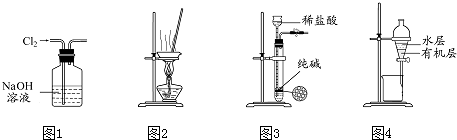

| A. | 用图1 所示装置除去Cl2中含有的少量HCl | |
| B. | 用图2 所示装置蒸干NH4HCO3饱和溶液制备NH4HCO3晶体 | |
| C. | 用图3 所示装置制取少量纯净的CO2气体 | |
| D. | 用图4 所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
8.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数为20.下列判断正确的是( )
| W | X | Y |
| Z |
| A. | Z、X、Y形成的气态氢化物稳定性依次增强 | |
| B. | 四种元素形成的单质最多有6种 | |
| C. | 四种元素的原子半径:rZ>rY>rX>rW | |
| D. | 四种元素中,X的氧化物对应的水化物酸性最强 |

