题目内容
8.写出下列反应的化学反应方程式,并判断其反应类型.①由乙烯制氯乙烷CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl,属于加成反应;
②由苯制取环己烷C6H6+3H2$→_{高温高压}^{Ni}$C6H12(环己烷),属于加成反应.
分析 ①乙烯分子含有碳碳双键,能与氯化氢在催化剂加热的条件下发生加成反应生成氯乙烷;
②苯环含有不饱和键,和氢气发生加成反应生成环己烷.
解答 解:有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应属于加成反应.
①乙烯结构简式为:CH2=CH2,分子中含有碳碳双键,能与氯化氢发生加成反应,反应方程式为:CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl,属于加成反应,
故答案为:CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl; 加成反应;
②在催化剂Ni的作用下,苯中不饱和键断裂,与氢原子相结合生成新的化合物,反应方程式为:C6H6+3H2$→_{高温高压}^{Ni}$C6H12(环己烷),属于加成反应,
故答案为:C6H6+3H2$→_{高温高压}^{Ni}$C6H12(环己烷);加成反应.
点评 本题考查有机化学反应方程式的书写,为高频考点,把握常见有机物的性质、反应类型为解答的关键,侧重加成反应类型的考查,题目难度不大.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
16.有如图反应:mA(g)?nB(g),当加压后,反应速率如图所示,推断系数m和n的关系是( )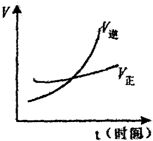

| A. | m>n | B. | m<n | C. | m=n | D. | 无法确定 |
16.NA表示阿伏伽德罗常数,下列判断正确的是( )
| A. | 32gO2和O3混合气体中含有原子总数为NA | |
| B. | 含有NA个Na+的Na2O溶于1L水中,Na+的物质的量浓度为2mol/L | |
| C. | 标准状况下,22.4L空气含有NA个单质分子 | |
| D. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA |
13.下列物质中,作为燃料时对空气没有污染的是( )
| A. | 原油 | B. | 氢气 | C. | 汽油 | D. | 煤 |
20.将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,下列说法正确的是( )
| A. | 只有AgBr沉淀生成 | B. | 生成等物质的量的AgCl和AgBr沉淀 | ||
| C. | 沉淀的物质的量:AgCl多于AgBr | D. | 沉淀的物质的量:AgCl少于AgBr |
17.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 标准状况下,22.4L庚烷完全燃烧所生成的气态产物的分子数为7 NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9 NA | |
| C. | 1mol乙烯分子中含有极性键数为4 NA | |
| D. | 1 mol醛基(-CHO)中含有的共用电子数为6 NA |
18.现有4.9gMgO、Mg(OH)2的固体混合物,与l00g9.8%的稀H2SO4恰好完全反应,形成不饱和溶液.则原固体混合物中镁元素的质量为( )
| A. | 1.2g | B. | 1.6g | C. | 2.4g | D. | 4.8g |

 F
F
 ④
④
 .
.