题目内容
13.某化学兴趣小组利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置.
请回答下列问题:
(1)仪器a的名称为分液漏斗;装置A的圆底烧瓶中盛放的固体物质可选用b(填序号).
a.氯化钠 b.氢氧化钠 c.碳酸钙
(2)装置F的圆底烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;装置E的洗气瓶中盛放的试剂为饱和氯化钠溶液,其作用是除去氯气中混有的氯化氢.装置D中浓硫酸的作用是干燥氯气.
(3)反应过程中,装置C的集气瓶中有大量白烟产生,另一种产物为空气的主要成分之一,该反应的化学方程式为8NH3+3Cl2=N2+6NH4Cl.
(4)从装置C的b处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有氢氧化钠溶液的洗气瓶.
分析 (1)依据仪器形状说出气名称;氢氧化钠、生石灰或者碱石灰具有吸水性,利用氢氧化钠、生石灰或者是碱石灰与浓氨水可制取氨气;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质;
(3)氨气与氯气发生氧化还原反应生成氯化铵和氮气;
(4)氯气有毒,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收过量的氯气.
解答 解:(1)依据仪器a形状可知a为:分液漏斗; 氢氧化钠、生石灰或者碱石灰具有吸水性,利用氢氧化钠、生石灰或者是碱石灰与浓氨水可制取氨气;故选:b;
故答案为:分液漏斗;b;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质,所以E中放的是饱和食盐水,作用除去氯气中的氯化氢,D中放的是浓硫酸,作用是干燥氯气;
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;饱和氯化钠溶液; 除去氯气中混有的氯化氢; 干燥氯气;
(3)氨气与氯气发生氧化还原反应生成氯化铵和氮气,方程式:8NH3+3Cl2=N2+6NH4Cl;
故答案为:8NH3+3Cl2=N2+6NH4Cl;
(4)氯气有毒,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收过量的氯气;
故答案为:氢氧化钠.
点评 本题考查实验方案的设计,熟悉氨气的制取、氯气的制取原理及物质的性质是解答本题的关键,注意各装置作用,题目难度中等.

①它们所含的分子数目之比为 1:1
②它们所含的O原子数目之比为 1:2
③它们所含的原子总数目之比为 2:3
④它们所含的C原子数目之比为 1:1
⑤它们所含的电子数目之比为 7:11.
| A. | ①②③④ | B. | ①②③ | C. | ②③④⑤ | D. | ①②③④⑤ |
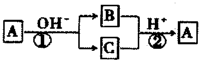
| A. | 反应①和②是可逆反应 | B. | 反应①和②一定为氧化还原反应 | ||
| C. | X元素可能是金属,也可能是非金属 | D. | X元素为铝 |
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 2 L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
| A. | 1.2g | B. | 1.6g | C. | 2.4g | D. | 4.8g |
| A. | A+3B?2C | B. | 2A+2B?3C | C. | 3A+B?C | D. | A+B?C |
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO2中少量的CO | 点燃 |
| B | 除去CuSO4溶液中的少量FeSO4 | 加入足量的铜粉 |
| C | 鉴别澄清石灰水和NaOH溶液 | 加入稀盐酸 |
| D | 鉴别硬水和软水 | 加入肥皂水 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1mol/L的甲酸溶液中c(H+)约为0.01mol/L | |
| B. | 甲酸与活泼金属反应生成氢气 | |
| C. | 10mL1mol/L的甲酸恰好与10mL1mol/L的NaOH溶液完全反应 | |
| D. | 在相同浓度下,甲酸的导电性比二元强酸溶液的弱 |

 F
F
 ④
④
 .
.