题目内容
8.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数为20.下列判断正确的是( )| W | X | Y |
| Z |
| A. | Z、X、Y形成的气态氢化物稳定性依次增强 | |
| B. | 四种元素形成的单质最多有6种 | |
| C. | 四种元素的原子半径:rZ>rY>rX>rW | |
| D. | 四种元素中,X的氧化物对应的水化物酸性最强 |
分析 X、Y、Z、W四种短周期元素,结合位置可知,W、X、Y为第二周期元素,Z为第三周期,设X的最外层电子数为x,则W的最外层电子数为x-1,Y的最外层电子数为x+1,Z的最外层电子数为x,则x+x+x-1+x+1=20,解得x=5,则W为C,X为N,Y为O,Z为P,然后结合元素周期律来解答.
解答 解:X、Y、Z、W四种短周期元素,结合位置可知,W、X、Y为第二周期元素,Z为第三周期,设X的最外层电子数为x,则W的最外层电子数为x-1,Y的最外层电子数为x+1,Z的最外层电子数为x,则x+x+x-1+x+1=20,解得x=5,则W为C,X为N,Y为O,Z为P,
A.非金属性越强,对应氢化物越稳定,则Z、X、Y形成的气态氢化物稳定性依次增强,故A正确;
B.C对应单质有金刚石、石墨、C60、C70等,O元素的单质有氧气、臭氧等,P的单质有白磷、红磷等,故B错误;
C.电子层越多,原子半径越大,同周期从左向右原子半径减小,则四种元素的原子半径:rZ>rW>rX>rY,故C错误;
D.四种元素中,X的最高价氧化物对应的水化物为硝酸,酸性最强,故D错误;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、最外层电子数推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
18.现有4.9gMgO、Mg(OH)2的固体混合物,与l00g9.8%的稀H2SO4恰好完全反应,形成不饱和溶液.则原固体混合物中镁元素的质量为( )
| A. | 1.2g | B. | 1.6g | C. | 2.4g | D. | 4.8g |
19.合成氨反应N2+3H2$?_{△}^{Fe}$2NH3,其化学反应速率可以用v(H2)、v(N2)、v(NH3)来表示,单位[mol/(L•s)],那么正确的关系式是( )
| A. | v(H2)=v(N2)=v(NH3) | B. | v(H2)=3v(N2) | C. | v(NH3)=1.5v(H2) | D. | v(N2)=2v(H2) |
16.某烃的相对分子质量小于70,1mol该烃最多可与2mol H2发生加成反应,加成产物最多能与10mol Cl2发生取代反应,则该烃的分子式为( )
| A. | C3H6 | B. | C3H4 | C. | C4H6 | D. | C5 H8 |
3.在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L的甲酸溶液中c(H+)约为0.01mol/L | |
| B. | 甲酸与活泼金属反应生成氢气 | |
| C. | 10mL1mol/L的甲酸恰好与10mL1mol/L的NaOH溶液完全反应 | |
| D. | 在相同浓度下,甲酸的导电性比二元强酸溶液的弱 |
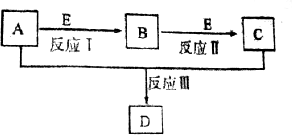
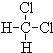 和
和 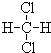
 与
与