题目内容
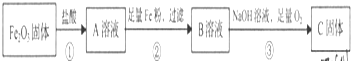
13.某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略).
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有漏斗、烧杯、玻璃棒.
(2)用MnCO3能除去溶液中的Al3+和Fe2+,其原理是消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀.
(3)己知Ksp(CuS)=1.2×10-36,Ksp(NiS)=1.2×10-21;在除铜镍的过程中,当Ni2+沉淀完全时[溶液中c(Ni2+)<1.0×10-5mo1.L-1],此时溶液中Cu2+的浓度6.0×10-26mo1•L-1.
(4)工业上用铁和石墨为电极,电解K2MnO4溶液制取KMnO4.电解时,应以隋性电极作阳极,阳极电极反应式为MnO42--e-═MnO4-,电解过程中,阴极附近溶液的pH将会增大(增大、减小、不变).
(5)工业上用碘-淀粉溶液测定燃煤尾气中SO2的含量.现有VamL浓度为cmo1•L-1的碘-淀粉溶液,取$\frac{1}{10}$去体积的混合溶液,当通入尾气体积为VbmL(已折算为标准状况)时,溶液蓝色消失.尾气中SO2的体积百分含量为:$\frac{2.24c{V}_{a}}{{V}_{b}}$×100%.
(6)除杂后得到的MnSO4溶液经过:蒸发浓缩、冷却结晶过滤及干燥得硫酸锰晶体(MnSO4•H2O).
分析 由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)过滤需要漏斗、烧杯、玻璃棒等;
(2)从消耗溶液中的酸,促进Al3+和Fe3+水解角度分析;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{Ksp(NiS)}{c(Ni{\;}^{2+})}$,结合Ksp(CuS)计算溶液中Cu2+的浓度;
(4)电解K2MnO4溶液制取KMnO4,要用隋性电极作阳极,铁作阴极,则阳极上K2MnO4失去电子发生氧化反应,阴极上是水中的氢离子放电生成氢气,据此分析;
(5)用碘-淀粉溶液测定燃煤尾气中SO2的含量,根据电子得失守恒有关系式I2~SO2,根据消耗碘的物质的量可计算出二氧化硫的体积,进而确定尾气中SO2的体积百分含量;
(6)由MnSO4溶液得到MnSO4•H2O晶体,应蒸发浓缩、冷却结晶、过滤及干燥.
解答 解:由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)过滤需要用到的硅酸盐仪器有漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒;
(2)由于碳酸锰能消耗溶液中的酸,降低溶液的酸性,从而促进Al3+和Fe3+水解生成氢氧化物沉淀,
故答案为:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{Ksp(NiS)}{c(Ni{\;}^{2+})}$=$\frac{1.4×10{\;}^{-24}}{1×10{\;}^{-5}}$=1.4×10-19,由Ksp(CuS)可知溶液中Cu2+的浓度为$\frac{8.4×10{\;}^{-45}}{1.4×10{\;}^{-19}}$=6.0×10-26mol/L,
故答案为:6.0×10-26;
(4)电解K2MnO4溶液制取KMnO4,要用隋性电极作阳极,铁作阴极,则阳极上K2MnO4失去电子发生氧化反应,电极反应式为MnO42--e-═MnO4-,阴极上是水中的氢离子放电生成氢气,所以阴极附近有氢氧根离子产生,溶液的pH将会增大,
故答案为:隋性电极;MnO42--e-═MnO4-;增大;
(5)用碘-淀粉溶液测定燃煤尾气中SO2的含量,根据电子得失守恒有关系式I2~SO2,反应中消耗碘的物质的量为VaL×10-3×cmo1•L-1×$\frac{1}{10}$=cVa×10-4mo1,所以二氧化硫的体积为cVa×10-4mo1×22.4L/mol=22.4cVa×10-4L=2.24cVamL,所以尾气中SO2的体积百分含量为$\frac{2.24cV{\;}_{a}mL}{V{\;}_{b}mL}$×100%=$\frac{2.24c{V}_{a}}{{V}_{b}}$×100%,
故答案为:$\frac{2.24c{V}_{a}}{{V}_{b}}$×100%;
(6)由MnSO4溶液得到MnSO4•H2O晶体,应蒸发浓缩、冷却结晶、过滤及干燥,
故答案为:蒸发浓缩、冷却结晶.
点评 本题以物质的制备实验考查混合物分离提纯的综合应用,为高频考点,涉及氧化还原反应、盐类水解、溶度积计算、原子守恒计算等,把握流程分析及混合物分离方法、发生的反应为解答的关键,侧重分析与实验、计算能力的考查,综合性较强,题目难度中等.

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案| A. | $\frac{a}{A+m}$(Z+m)mol 质子 | B. | $\frac{a}{A}$(A-Z+m)mol 中子 | C. | $\frac{a}{A+m}$(Z-m)mol 质子 | D. | $\frac{a}{A}$m mol 氢元素 |

| A. | 三聚氰胺的分子式为C3H6N6 | |
| B. | 三聚氰胺分子中的所有原子均位于同一平面上 | |
| C. | 三聚氰胺的一取代物只有一种 | |
| D. | 三聚氰胺不属于芳香烃 |
| A. | ①②③ | B. | ①②⑤ | C. | ②④⑤ | D. | ②③⑤ |
| A. | 1mol SiO2中共价键总数为2NA | |
| B. | 常温下,64g NO2中含质子总数为23NA | |
| C. | 标准状况下,22.4L丙烯和环丙烯的混合气体中氢原子个数为0.2NA | |
| D. | 0.2mol Fe在0.2mol Cl2中燃烧失去的电子数为0.6NA |
| A. | 实验室可用排饱和食盐水的方法收集氯气 | |
| B. | 将氯化铜溶液加热蒸干最终得不到氯化铜固体 | |
| C. | 钢铁在潮湿的空气中容易生锈 | |
| D. | 常温下,Ksp(MnS)>Ksp(CuS),工业上可用MnS除去废水中的Cu2+ |
 金属及其化合物在人类生产、生产中发挥着重要的作用.
金属及其化合物在人类生产、生产中发挥着重要的作用.