题目内容
3.请根据如下所示实验过程,回答相关问题: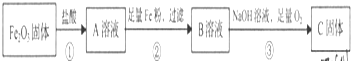
(1)反应①、②、③中属于氧化还原反应的是②、③.
(2)向A溶液中滴入儿滴KSCN溶液后,可观察到的现象是溶液呈血红色.
(3)C的化学式是Fe(OH)3.
(4)写出反应①的化学方程式Fe2O3+6HCl═2FeCl3+3H2O.
写出反应②的离子方程式2Fe3++Fe=3Fe2+.
分析 氧化铁是碱性氧化物与盐酸反应生成氯化铁和盐酸的混合溶液,加入足量的铁粉过滤,滤液中含有氯化亚铁,通入氢氧化钠和氧气,得到氢氧化铁,由此分析解答.
解答 解:氧化铁是碱性氧化物与盐酸反应生成氯化铁和盐酸的混合溶液,加入足量的铁粉过滤,滤液中含有氯化亚铁,通入氢氧化钠和氧气,得到氢氧化铁,
(1)反应①是碱性氧化物和酸反应,是复分解反应、②是铁离子与铁发生氧化还原反应、③氢氧化亚铁被氧化成氢氧化铁,属于氧化还原反应的是②、③,故答案为:②、③;
(2)向A溶液是氯化铁溶液,所以滴入儿滴KSCN溶液后,可观察到的现象是溶液呈血红色,故答案为:溶液呈血红色;
(3)C的化学式是Fe(OH)3,故答案为:Fe(OH)3;
(4)写出反应①是氧化铁与盐酸反应生成氯化铁与水,化学方程式为Fe2O3+6HCl═2FeCl3+3H2O,反应②是铁与铁离子的氧化还原反应,离子方程式为:2Fe3++Fe=3Fe2+,故答案为:Fe2O3+6HCl═2FeCl3+3H2O;2Fe3++Fe=3Fe2+.
点评 本题考查金属及其化合物的性质,为高频考点,把握铁及其化合物的性质及发生的氧化还原反应为解答的关键,侧重分析与应用能力的考查,综合性较强,涉及离子反应、化学反应等,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
14.X、Y、Z、W、M为原子序数依次增大的短周期主族元素.已知:
①原子半径:X<Z<Y<M<W
②原子的最外层电子数:X=W,X+Y=Z=2M
③Y元素的主要化合价:最高正价+最低负价=2
下列说法不正确的是( )
①原子半径:X<Z<Y<M<W
②原子的最外层电子数:X=W,X+Y=Z=2M
③Y元素的主要化合价:最高正价+最低负价=2
下列说法不正确的是( )
| A. | X、Z两种元素可形成X2Z和X2Y2两种常见共价化合物 | |
| B. | 工业上常用电解熔融的W和M氯化物的方法分别制取W、M两种单质 | |
| C. | M的最高价氧化物与Y、W两元素最高价氧化物对应水化物均能反应生成盐和水 | |
| D. | X与W可形成离子化合物,且该离子化合物具有较强还原性 |
11.已知标准状况下5.6LX气体的质量为8g,则X气体的摩尔质量是( )
| A. | 16g | B. | 32g | C. | 64g/mol | D. | 32g/mol |
18.已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.83kJ/mol
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.9kJ/mol
若氢气与一氧化碳的混合气体完全燃烧可生成5.4gH2O(l),并放出114.3kJ热量,则混合气体中CO的物质的量为( )
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.9kJ/mol
若氢气与一氧化碳的混合气体完全燃烧可生成5.4gH2O(l),并放出114.3kJ热量,则混合气体中CO的物质的量为( )
| A. | 0.1 mol | B. | 0.15 mol | C. | 0.22 mol | D. | 0.05 mol |
8.由丙烷、乙烯和乙炔组成的混合气体,完全燃烧生成CO2和H2O的物质的量相等,则原混合气体中三种组分的体积比为( )
| A. | 1:2:4 | B. | 1:2:3 | C. | 3:2:1 | D. | 2:5:2 |
12.元素及其化合物转化关系是化学学习的重要内容之一.下列各组物质的转化关系中不全部是通过一步反应完成的是( )
| A. | N2→NH3→NO→NO2→HNO3 | B. | Na→Na2O2→NaOH→Na2CO3 | ||
| C. | S→SO3→H2SO4→Na2SO4 | D. | Si→SiO2→Na2SiO3→H2SiO3 |
 .
.