题目内容
5.设NA为阿伏伽德罗常数,下列叙述正确的是( )| A. | 1mol SiO2中共价键总数为2NA | |
| B. | 常温下,64g NO2中含质子总数为23NA | |
| C. | 标准状况下,22.4L丙烯和环丙烯的混合气体中氢原子个数为0.2NA | |
| D. | 0.2mol Fe在0.2mol Cl2中燃烧失去的电子数为0.6NA |
分析 A、二氧化硅中1个硅原子形成4条Si-O键;
B、求出二氧化氮的物质的量,然后根据1mol二氧化氮中含23mol质子来分析;
C、求出混合物的物质的量,然后根据丙烯中含6个氢原子,而环丙烯中含4个氢原子来分析;
D、0.2mol Fe在0.2mol Cl2中,氯气不足,铁过量.
解答 解:A、二氧化硅中1个硅原子形成4条Si-O键,故1mol二氧化硅中含4molSi-O键,即4NA个,故A错误;
B、64g二氧化氮的物质的量为n=$\frac{64g}{64g/mol}$=1mol,而1mol二氧化氮中含23mol质子,即23NA个,故B正确;
C、标况下22.4L混合物的物质的量为1mol,而丙烯中含6个氢原子,环丙烯中含4个氢原子,故1mol混合物中含有的氢原子数介于4NA到6NA之间,故C错误;
D、0.2mol Fe在0.2mol Cl2中,氯气不足,铁过量,由于反应后氯元素变为-1价,故0.2mol氯气转移0.4mol电子即0.4NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
16.下列有关物质鉴别的方法描述错误的是( )
| A. | 用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 用氢氧化钠溶液鉴别Al2(SO4)3和 MgSO4两种无色溶液 | |
| C. | 用焰色反应实验来鉴别NaNO3固体和 KNO3固体 | |
| D. | 用澄清石灰水鉴别碳酸钠和碳酸氢钠 |
10.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 23gNa在氧气中完全燃烧失电子数为0.5NA | |
| B. | 1mol NO和1mol O2的混合气体中含有的分子数为2NA | |
| C. | 标准状况下,11.2L SO3所含分子数为0.5NA | |
| D. | 1.5mol NO2与足量H2O反应,转移的电子数为NA |
4.其它条件不变时仅升高温度,一定增大的是( )
| A. | 强碱在水中的溶解度 | B. | 吸热反应的热效应 | ||
| C. | 化学平衡常数K | D. | 盐类水解程度 |
5.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:CrO${\;}_{4}^{2-}$$→_{转换}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{还原}^{Fe_{2}+}$Cr3+$→_{沉淀}^{OH-}$Cr(OH)3↓已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(1)[MCr=52,M(FeS04•7H2O)=278]转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 | |
| D. | 2V正(CrO42-)=V逆(Cr2O72-)时,反应处于平衡态 |

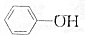 ,③
,③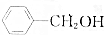 ,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )
,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )