题目内容
9.下列事实不能说明醋酸属于弱电解质的是( )| A. | 0.1mol/L CH3COONa溶液显碱性 | |
| B. | 0.1mol/L醋酸溶液的pH=3 | |
| C. | 物质的量浓度相同的盐酸和醋酸同时与锌反应,开始时锌粒跟盐酸反应比跟醋酸反应的速率快 | |
| D. | 中和100mL1mol/L 的CH3COOH溶液需要100mL1mol/L的NaOH溶液 |
分析 证明醋酸是弱电解质,可证明存在电离平衡、部分电离或对应的强碱盐溶液呈碱性,以此解答.
解答 解:A.CH3COONa溶液显碱性,可说明为强碱弱酸盐,可证明醋酸为弱酸,故A不选;
B.0.01mol/L醋酸溶液的pH=3,说明醋酸没有完全电离,可证明为弱酸,故B不选;
C.开始时锌粒跟盐酸反应的速率比跟醋酸反应的速率快,说明等浓度的盐酸溶液中氢离子浓度大,即醋酸不完全电离,则可说明醋酸为弱酸,故C不选;
D.酸碱的物质的量相同,完全发生中和反应,与酸的强弱无关,不能证明为弱酸,故D选;
故选D.
点评 本题考查弱电解质的判断,明确弱电解质的性质是解答本题的关键,常用的方法是利用电离的不完全性,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
6.下列分子式所代表的物质具有题中所指类别(括号中)的同分异构体数目不同的是( )
| A. | C4H10 O (醇类) | B. | C3H6Cl(不饱和卤代烃) | ||
| C. | C4H8O2(酯类) | D. | C9H12(芳香烃) |
7.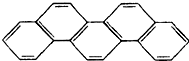 有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )
有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )
 有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )
有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )| A. | 该有机物属芳香烃 | |
| B. | 该物质属氨基酸 | |
| C. | 该物质分子中只含非极性键 | |
| D. | 该物质完全燃烧产生水的物质的量小于CO2的物质的量 |
4.对于炔烃的描述中,不正确的是( )
| A. | 分子中含有碳碳三键的不饱和链烃 | |
| B. | 易发生加成反应 | |
| C. | 既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 | |
| D. | 分子里所有的碳原子都处于同一直线上 |
4.下列实验过程中,始终无明显现象的是( )
| A. | O2通入酸化的KI淀粉溶液中 | |
| B. | CO2通入CaCl2溶液中 | |
| C. | 0.1mol•L-l稀H2SO4滴入0.1 mol•L-1Na2S2O3溶液中 | |
| D. | 0.2mol•L-1H2C2O4溶液滴入酸化的KMnO4溶液中 |
14.下列说法正确的是( )
| A. | NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$的值及SO2转化率不变 |
19.决定元素种类的是( )
| A. | 质子数 | B. | 电子数 | C. | 中子数 | D. | 质子数和中子数 |
