题目内容
4.下列实验过程中,始终无明显现象的是( )| A. | O2通入酸化的KI淀粉溶液中 | |
| B. | CO2通入CaCl2溶液中 | |
| C. | 0.1mol•L-l稀H2SO4滴入0.1 mol•L-1Na2S2O3溶液中 | |
| D. | 0.2mol•L-1H2C2O4溶液滴入酸化的KMnO4溶液中 |
分析 A、发生氧化还原反应生成碘,离子反应为4I-+4H++O2=2I2+2H2O;
B、碳酸的酸性小于盐酸;
C、发生Na2S2O3+H2SO4═Na2SO4+S↓+H2SO3;
D、H2C2O4溶液滴入酸化的KMnO4溶液中,发生氧化还原反应紫色褪去.
解答 解:A、发生氧化还原反应生成碘,离子反应为4I-+4H++O2=2I2+2H2O,所以溶液变蓝,故A不符合;
B、碳酸的酸性小于盐酸,无任何现象,故B符合;
C、发生Na2S2O3+H2SO4═Na2SO4+S↓+H2SO3,生成白色沉淀,故C不符合;
D、H2C2O4溶液滴入酸化的KMnO4溶液中,发生氧化还原反应紫色褪去,有明显现象,故D不符合;
故选B.
点评 本题考查化学反应发生条件及其现象,注重基础知识考查,难度中等.

练习册系列答案
相关题目
1.工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸).
【反应原理】
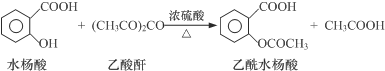
【物质性质】
【实验流程】
(1)物质制备:向125mL的锥形瓶中依次加入4g水杨酸、10mL乙酸酐(密度为1.08g/mL)、0.5mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10min.
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是水杨酸属于酚类物质,会被浓H2SO4氧化.
②控制反应温度85℃~90℃的原因既保证有较高的反应速率又减少了物质的挥发.
(2)产品结晶:取出锥形瓶,加入50mL蒸馏水冷却.待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干.简要叙述如何洗涤布氏漏斗中的晶体?向布氏漏斗中加入冰水至浸没所有晶体,重复2~3次.
(3)产品提纯:将粗产品转移至150mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止.进一步提纯最终获得乙酰水杨酸3.6g.
①试剂X为饱和碳酸钠溶液.
②实验中乙酰水杨酸的产率为69%(已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180).
(4)纯度检验:取少许产品加入盛有5mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是产品中仍然可能含有水杨酸.
【反应原理】

【物质性质】
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | |
| 乙酸酐 | 139 | 在水中逐渐分解 | |
| 乙酰水杨酸 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
(1)物质制备:向125mL的锥形瓶中依次加入4g水杨酸、10mL乙酸酐(密度为1.08g/mL)、0.5mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10min.
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是水杨酸属于酚类物质,会被浓H2SO4氧化.
②控制反应温度85℃~90℃的原因既保证有较高的反应速率又减少了物质的挥发.
(2)产品结晶:取出锥形瓶,加入50mL蒸馏水冷却.待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干.简要叙述如何洗涤布氏漏斗中的晶体?向布氏漏斗中加入冰水至浸没所有晶体,重复2~3次.
(3)产品提纯:将粗产品转移至150mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止.进一步提纯最终获得乙酰水杨酸3.6g.
①试剂X为饱和碳酸钠溶液.
②实验中乙酰水杨酸的产率为69%(已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180).
(4)纯度检验:取少许产品加入盛有5mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是产品中仍然可能含有水杨酸.
19.下列反应的离子方程式正确的是( )
| A. | 向Ba(0H)2溶液中滴H2SO4溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 明矾溶液中加氢氧化钡溶液,使其产生沉淀的物质的量达最大值:Al3++2SO42-+2Ba+4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ | |
| D. | 向100mL0.1mol/L的FeBr2溶液中通入0.012molCl2:10Fe2++14Br-+12Cl2═10Fe3++7Br2+24Cl- |
9.下列事实不能说明醋酸属于弱电解质的是( )
| A. | 0.1mol/L CH3COONa溶液显碱性 | |
| B. | 0.1mol/L醋酸溶液的pH=3 | |
| C. | 物质的量浓度相同的盐酸和醋酸同时与锌反应,开始时锌粒跟盐酸反应比跟醋酸反应的速率快 | |
| D. | 中和100mL1mol/L 的CH3COOH溶液需要100mL1mol/L的NaOH溶液 |
16.X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置如表所示;X的单质在氧气中燃烧能生成两种无色气体,Y的最简单气态氢化物的水溶液显碱性.
回答下列问题:
(1)元素X在周期表中位于IVA族;W和Z的气态氢化物稳定性比较,其较强的是HCl(填化学式).
(2)W的单质与水反应生成的含氧酸的电子式为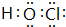
(3)在BaCl2溶液中加入少量Y的最高价氧化物对应水化物溶液,再通入ZO2气体,能生成无色气体YO和白色沉淀BaSO4(填化学式);ZO2和YO还原性比较,其较强的是SO2(填化学式).
| X | ||
| Z |
(1)元素X在周期表中位于IVA族;W和Z的气态氢化物稳定性比较,其较强的是HCl(填化学式).
(2)W的单质与水反应生成的含氧酸的电子式为
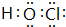
(3)在BaCl2溶液中加入少量Y的最高价氧化物对应水化物溶液,再通入ZO2气体,能生成无色气体YO和白色沉淀BaSO4(填化学式);ZO2和YO还原性比较,其较强的是SO2(填化学式).
13.“学做营养师,我来配食谱.”我们来帮小明同学完成下列食谱.
除了水和无机盐之外,上表食谱中,含有的营养素主要有糖类、蛋白质(或油脂)等(写两种);我认为小明列出的食谱中还缺少一种人体所必需的营养素维生素,“我的补充”是青菜(填写获取该营养素的一种食物名称).
| 主食 | 米饭 | 馒头 | ||
| 副食 | 烧鱼块 | 咸鸡蛋 | 红烧肉 | 花生米 |
| 饮料 | 牛奶 | |||
| 我的 |
14.下列各组溶液,不用其它试剂就不能将它们区别开的是( )
| A. | 石灰水和碳酸钠 | B. | 偏铝酸钠和盐酸 | ||
| C. | 石灰水和磷酸 | D. | 硫酸铝和氢氧化钠 |
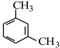 .
.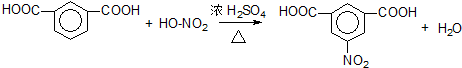 .
. 、
、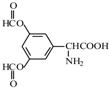 .
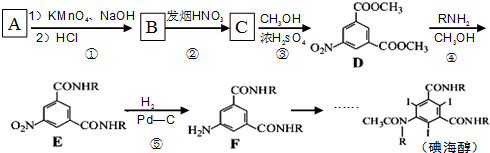
.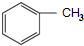 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 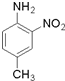 的合成路线流
的合成路线流
 呈弱碱性,易被氧化
呈弱碱性,易被氧化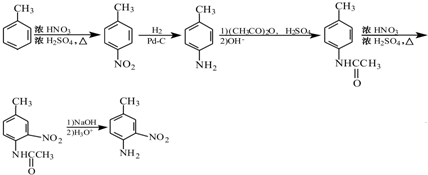 .
. 如图所示实验装置可用于制取乙炔.
如图所示实验装置可用于制取乙炔.