题目内容
下列排列顺序正确的是( )
①酸性:H3PO4>H2SO4>HClO4
②热稳定性:H2O>HF>H2S
③原子半径:Na>Mg>O
④还原性:F->Cl->S2-
⑤结合H+的能力:OH->CH3COO->Cl-.
①酸性:H3PO4>H2SO4>HClO4
②热稳定性:H2O>HF>H2S
③原子半径:Na>Mg>O
④还原性:F->Cl->S2-
⑤结合H+的能力:OH->CH3COO->Cl-.
| A、③⑤ | B、②③ |
| C、①③④ | D、②④⑤ |
考点:同一周期内元素性质的递变规律与原子结构的关系,同一主族内元素性质递变规律与原子结构的关系
专题:
分析:①非金属越强,则其最高价氧化物的水化物的酸性越强;
②非金属性越强,则其氢化物的稳定性越强;
③电子层数越多原子半径越大,电子层数相同时,原子序数越大,半径越小;
④元素的非金属性越强,对应阴离子的还原性越弱;
⑤酸性越强,酸越易电离出氢离子,对应阴离子越难结合氢离子;
②非金属性越强,则其氢化物的稳定性越强;
③电子层数越多原子半径越大,电子层数相同时,原子序数越大,半径越小;
④元素的非金属性越强,对应阴离子的还原性越弱;
⑤酸性越强,酸越易电离出氢离子,对应阴离子越难结合氢离子;
解答:
解:①非金属越强,则其最高价氧化物的水化物的酸性越强,非金属性:P<S<Cl,则酸性:H3PO4<H2SO4<HClO4,故错误;
②非金属性越强,则其氢化物的稳定性越强,非金属性:F>O>S,则热稳定性:HF>H2O>H2S,故错误;
③电子层数越多原子半径越大,则半径Na和Mg大于O,电子层数相同时,原子序数越大,半径越小,则半径Na>Mg,所以原子半径:Na>Mg>O,故正确;
④元素的非金属性越强,对应阴离子的还原性越弱,非金属性:F>Cl>S,则还原性:F-<Cl-<S2-,故错误;
⑤酸性越强,酸越易电离出氢离子,对应阴离子越难结合氢离子,酸性HCl>CH3COOH>H2O,则结合H+的能力:OH->CH3COO->Cl-,故正确;
所以正确的有③⑤;
故选A.
②非金属性越强,则其氢化物的稳定性越强,非金属性:F>O>S,则热稳定性:HF>H2O>H2S,故错误;
③电子层数越多原子半径越大,则半径Na和Mg大于O,电子层数相同时,原子序数越大,半径越小,则半径Na>Mg,所以原子半径:Na>Mg>O,故正确;
④元素的非金属性越强,对应阴离子的还原性越弱,非金属性:F>Cl>S,则还原性:F-<Cl-<S2-,故错误;
⑤酸性越强,酸越易电离出氢离子,对应阴离子越难结合氢离子,酸性HCl>CH3COOH>H2O,则结合H+的能力:OH->CH3COO->Cl-,故正确;
所以正确的有③⑤;
故选A.
点评:本题考查了元素性质的递变规律,题目难度不大,注意把握非金属元素的性质的变化规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
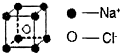

| A、1mol白磷晶体中含有的P-P键的个数为4NA |
| B、12g金刚石中含有的C-C键的个数为1.5NA |
| C、12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| D、1mol氯化钠(晶胞如图)中含有Na+数目为8NA |
已知:H2(g)+F2(g)═2HF(g)△H=-270kJ?mol-1,下列说法正确的是( )
| A、2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量 |
| B、1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| C、在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 |
| D、1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
下列说法正确的是( )
| A、SO2、SO3都是极性分子 |
| B、凡是中心原子采取sp3杂化轨道成键的分子其空间构型都是正四面体 |
| C、同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物 |
| D、干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
下列说法正确的是( )
| A、O2的摩尔质量为32g |
| B、22.4LCO和H2的混合气体所含分子数为NA |
| C、0.1molN2和O2的混合气体在标准状况下的体积为2.24L |
| D、若1 molCO2所占体积为22.4L,则其所处状况一定为标准状况 |
下列说法正确的是( )
| A、气体摩尔体积就是22.4L/mol |
| B、非标准状况下,1mol任何气体的体积不可能为22.4L |
| C、标准状况下22.4L任何物质都含有约6.02×1023个分子 |
| D、1molH2和O2的混合气体在标准状况下的体积约22.4L |
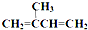 )为主要原料来进行的有机合成:
)为主要原料来进行的有机合成: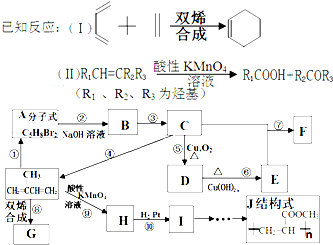
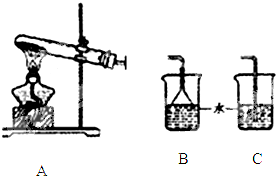 某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2
某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2