题目内容
写出下列物质在水中的电离方程式.
(1)碳酸钠
(2)氢氧化钡
(3)醋酸 .
(1)碳酸钠
(2)氢氧化钡
(3)醋酸
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:先判断强电解质还是弱电解质,根据强电解质完全电离,电离方程式用等号,弱电解质部分电离,电离方程式用可逆号;如果是多元弱酸,要分步电离,如果是多元弱碱,只需一步书写,最后要注意原子守恒、电荷守恒.
解答:
解:(1)碳酸钠是强电解质,完全电离,电离出Na+、CO32-,即Na2CO3=2Na++CO32-,故答案为:Na2CO3=2Na++CO32-;
(2)氢氧化钡为强碱,溶液中完全电离,电离方程式用可等号,氢氧化钡的电离方程式为Ba(OH)2=Ba2++2OH-,故答案为:Ba(OH)2=Ba2++2OH-;
(3)醋酸为弱酸,液中部分电离,电离方程式用可逆符号,电离方程式为CH3COOH?H++CH3COO-,故答案为:CH3COOH?H++CH3COO-.
(2)氢氧化钡为强碱,溶液中完全电离,电离方程式用可等号,氢氧化钡的电离方程式为Ba(OH)2=Ba2++2OH-,故答案为:Ba(OH)2=Ba2++2OH-;
(3)醋酸为弱酸,液中部分电离,电离方程式用可逆符号,电离方程式为CH3COOH?H++CH3COO-,故答案为:CH3COOH?H++CH3COO-.
点评:本题考查了电离方程式的书写,题目难度中等,注意掌握强电解质与弱电解质的判断方法,能够根据电离方程式的书写原则正确书写常见的电解质的电离方程式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、纤维素属于多糖,在人体内水解转化为葡萄糖,也可为人类提供能量 |
| B、糖尿病患者吃糖量必须限制,但淀粉类食物不必进行限制 |
| C、同质量的脂肪在体内氧化放出的能量比糖类和蛋白质高得多,是提供能量的主要物质 |
| D、葡萄糖在人体内不可以转化为脂肪,所以吃糖不会使人发胖 |
将一定量的Na2SO4溶于90ml水中,使得每100个水分子中溶有一个Na+,这一定量的Na2SO4是 (( )
| A、142g |
| B、71g |
| C、0.05mol |
| D、0.025mol |
下列排列顺序正确的是( )
①酸性:H3PO4>H2SO4>HClO4
②热稳定性:H2O>HF>H2S
③原子半径:Na>Mg>O
④还原性:F->Cl->S2-
⑤结合H+的能力:OH->CH3COO->Cl-.
①酸性:H3PO4>H2SO4>HClO4
②热稳定性:H2O>HF>H2S
③原子半径:Na>Mg>O
④还原性:F->Cl->S2-
⑤结合H+的能力:OH->CH3COO->Cl-.
| A、③⑤ | B、②③ |
| C、①③④ | D、②④⑤ |
下列关于物理量的说法正确的是( )
| A、0.012kg C-12(12C)所含有的碳原子物质的量为1mol |
| B、SO42-的摩尔质量是 98 g?mol-1 |
| C、1 mol任何气体所占体积都约是22.4 L |
| D、阿伏加德罗常数等于6.02×1023 mol-1 |
下列有关水的说法错误的是( )
| A、水是氧化物 |
| B、煮沸可降低自来水的硬度 |
| C、肥皂水可区分硬水和软水 |
| D、电解水的实验,说明水是由氢气和氧气组成的 |
下列说法正确的是( )
| A、在100℃、101 KPa条件下,1mol液态水汽化为水蒸气吸收的热量为40.69KJ,则H2O(g)?H2O(l) 的△H=-40.69KJ/mol |
| B、已知MgCO3的Ksp=6.82×10-4mol2/L2,则所有含固体MgCO3的溶液中,都有C(Mg 2+ )=C(CO32-),且 C(Mg2+)?C(CO32-)=6.82×10-4mol2/L2 |
| C、已知:C-C的键能348KJ/mol,C=C的键能610KJ/mol,C-H的键能413KJ/mol, H-H的键能436KJ/mol, 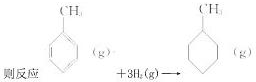 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol |
| D、碳酸氢钠溶液中存在:c(H*)+c(H2CO3)=c(OH-)+c(CO32-) |