题目内容
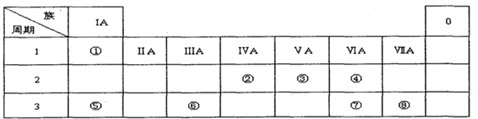
下表是元素周期表的一部分,回答下列有关问题:
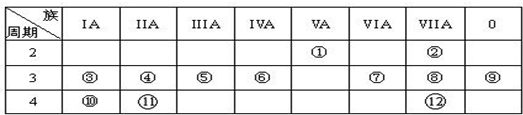
(1)写在①~(12)元素中最不活泼的元素的原子结构示意图
(2)某元素二价阳离子的核外有18个电子,该元素是 (填元素名称)
(3)②⑥⑦元素形成的气态氢化物的稳定性从强到弱的顺序为 (填相应物质的化学式)
(4)元素 ③与元素 ④相比,金属性较强的是 (填元素符号),设计实验证明你的结论
(5)元素⑧和元素(12)的最高价氧化物对应水化物的酸性强弱顺序为
(6)元素⑤形成的单质与元素③的最高价氧化物对应水化物反应的离子方程式为 .

(1)写在①~(12)元素中最不活泼的元素的原子结构示意图
(2)某元素二价阳离子的核外有18个电子,该元素是
(3)②⑥⑦元素形成的气态氢化物的稳定性从强到弱的顺序为
(4)元素 ③与元素 ④相比,金属性较强的是
(5)元素⑧和元素(12)的最高价氧化物对应水化物的酸性强弱顺序为
(6)元素⑤形成的单质与元素③的最高价氧化物对应水化物反应的离子方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦S、⑧为Cl、⑨为Ar、⑩为K、⑾为Ca、⑿为Br.
(1)稀有气体Ar的化学性质最不活泼,Ar原子核外电子数为18,有3个电子层,各层电子数为2、8、8;
(2)某元素二价阳离子的核外有18个电子,则该元素质子数为18+2=20,为钙元素;
(3)非金属性越强,氢化物越稳定;
(4)同周期自左而右元素金属性减弱,根据金属与水的反应进行证明;
(5)非金属性越强,最高价含氧酸的酸性越强;
(6)铝与氢氧化钠反应生成偏铝酸钠与氢气.
(1)稀有气体Ar的化学性质最不活泼,Ar原子核外电子数为18,有3个电子层,各层电子数为2、8、8;
(2)某元素二价阳离子的核外有18个电子,则该元素质子数为18+2=20,为钙元素;
(3)非金属性越强,氢化物越稳定;
(4)同周期自左而右元素金属性减弱,根据金属与水的反应进行证明;
(5)非金属性越强,最高价含氧酸的酸性越强;
(6)铝与氢氧化钠反应生成偏铝酸钠与氢气.
解答:
解:由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦S、⑧为Cl、⑨为Ar、⑩为K、⑾为Ca、⑿为Br.
(1)稀有气体Ar的化学性质最不活泼,Ar原子核外电子数为18,有3个电子层,各层电子数为2、8、8,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)某元素二价阳离子的核外有18个电子,则该元素质子数为18+2=20,为钙元素,故答案为:钙;
(3)非金属性F>Si>S,非金属性越强,氢化物越稳定,故氢化物稳定性:HF>H2S>SiH4,故答案为:HF>H2S>SiH4;
(4)同周期自左而右元素金属性减弱,故金属性Na>Mg,根据金属与水的反应进行证明,常温下,Na与冷水发生剧烈反应,而Mg与冷水反应缓慢,说明Na的金属性更强,故答案为:Na;常温下,Na与冷水发生剧烈反应,而Mg与冷水反应缓慢;
(5)非金属性Cl>Br,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>HBrO4,故答案为:HClO4>HBrO4;
(6)铝与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(1)稀有气体Ar的化学性质最不活泼,Ar原子核外电子数为18,有3个电子层,各层电子数为2、8、8,原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(2)某元素二价阳离子的核外有18个电子,则该元素质子数为18+2=20,为钙元素,故答案为:钙;
(3)非金属性F>Si>S,非金属性越强,氢化物越稳定,故氢化物稳定性:HF>H2S>SiH4,故答案为:HF>H2S>SiH4;
(4)同周期自左而右元素金属性减弱,故金属性Na>Mg,根据金属与水的反应进行证明,常温下,Na与冷水发生剧烈反应,而Mg与冷水反应缓慢,说明Na的金属性更强,故答案为:Na;常温下,Na与冷水发生剧烈反应,而Mg与冷水反应缓慢;
(5)非金属性Cl>Br,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>HBrO4,故答案为:HClO4>HBrO4;
(6)铝与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评:本题考查元素周期表与元素周期律综合应用,侧重对元素周期律的考查,难度不大,注意理解掌握金属性、非金属性强弱比较及实验事实.

练习册系列答案
相关题目
下列物质在水溶液中的电离方程式书写正确的是( )
| A、NaHSO4═Na++HSO4- |
| B、NaHCO3═Na++H++CO32- |
| C、CH3COOH═H++CH3COO- |
| D、NH3?H2O?NH4++OH- |