题目内容
下列物质在水溶液中的电离方程式书写正确的是( )
| A、NaHSO4═Na++HSO4- |
| B、NaHCO3═Na++H++CO32- |
| C、CH3COOH═H++CH3COO- |
| D、NH3?H2O?NH4++OH- |
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:A.硫酸氢钠为强电解质,在溶液中完全电离出钠离子、氢离子和硫酸根离子,硫酸氢根离子应该拆开;
B.碳酸氢根离子不能拆开,应该写成HCO3-离子整体形式;
C.醋酸为弱酸,其电离方程式应该使用可逆号;
D.一水合氨为弱碱,溶液中存在电离平衡,电离方程式用可逆号.
B.碳酸氢根离子不能拆开,应该写成HCO3-离子整体形式;
C.醋酸为弱酸,其电离方程式应该使用可逆号;
D.一水合氨为弱碱,溶液中存在电离平衡,电离方程式用可逆号.
解答:
解:A.硫酸氢钠在溶液中电离出钠离子、氢离子和硫酸根离子,硫酸氢钠正确的电离方程式为:NaHSO4═Na++H++SO42-,故A错误;
B.碳酸氢钠为强电解质,在溶液中电离出钠离子、碳酸氢根离子,碳酸氢根离子不能拆开,正确的电离方程式为:NaHCO3═Na++HCO3-,故B错误;
C.醋酸为弱电解质,溶液中部分电离出氢离子、醋酸根离子,正确的电离方程式为:CH3COOH?H++CH3COO-,故C错误;
D.一水合氨为弱电解质,溶液中存在电离平衡,其电离方程式为:NH3?H2O?NH4++OH-,故D正确;
故选D.
B.碳酸氢钠为强电解质,在溶液中电离出钠离子、碳酸氢根离子,碳酸氢根离子不能拆开,正确的电离方程式为:NaHCO3═Na++HCO3-,故B错误;
C.醋酸为弱电解质,溶液中部分电离出氢离子、醋酸根离子,正确的电离方程式为:CH3COOH?H++CH3COO-,故C错误;
D.一水合氨为弱电解质,溶液中存在电离平衡,其电离方程式为:NH3?H2O?NH4++OH-,故D正确;
故选D.
点评:本题考查了电离方程式的书写判断,题目难度不大,注意掌握强弱电解质的概念及判断方法,明确电离方程式的书写原则,如:弱电解质部分电离,电离方程式用可逆号,强电解质用等号.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列关于有机化合物的叙述中正确的是( )
| A、KMnO4酸性溶液既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 |
| B、在混有乙酸的乙酸乙酯中加入NaOH溶液可以达到除杂的目的 |
| C、丙烯的结构简式可以表示为CH3CHCH2 |
| D、CH2Cl2是纯净物说明甲烷是四面体结构而不是正方形 |
下列说法不正确的是( )
| A、利用盖斯定律可计算某些难以直接测量的反应焓变 |
| B、如果一个化学方程式通过其他几个化学方程式相加减而得到,则该反应的焓变可由相关的化学方程式的焓变相加减而得到 |
| C、对于放热反应,放出的热量越多,焓变越小 |
| D、当同一个化学反应以不同的过程完成时,反应的焓变是不同的 |
对下列事实的解释正确的是( )
| A、常温下,将铜放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中钝化 |
| B、浓硝酸在光照下变黄,证明硝酸不稳定,且产物有红棕色气体可溶于浓硝酸 |
| C、溴蒸气使湿润的碘化钾淀粉试纸变蓝,说明溴可与淀粉反应 |
| D、液氨是一种重要的制冷剂,说明氨气在液化时吸收大量的热 |
分析如面的能量变化示意图,确定下列选项中正确的是( )
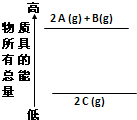

| A、2 A(g)+B(g)=2 C(g);△H<0 |
| B、2 A(g)+B(g)=2 C(g);△H>0 |
| C、2A+B=2 C;△H<0 |
| D、2C=2 A+B;△H<0 |
 如图,关闭活塞K,向A中充入1mol X、1mol Y,向B中充入2mol X、2mol Y,此时A、B的容积都是a L.在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L.下列说法正确的是( )
如图,关闭活塞K,向A中充入1mol X、1mol Y,向B中充入2mol X、2mol Y,此时A、B的容积都是a L.在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L.下列说法正确的是( )| A、反应速率:v(B)<v(A) |
| B、A 容器中X的转化率为80% |
| C、平衡时的压强:2p(A)=p(B) |
| D、平衡时Y的体积分数:A>B |
下列说法正确的是( )
| A、PM 2.5(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶而对人体产生危害 |
| B、明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| C、地沟油对身体有害不能用作食用油,但可以在循环经济中发挥作用 |
D、塑化剂的基本结构为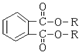 ,因此可以水解成对人体无害的物质 ,因此可以水解成对人体无害的物质 |