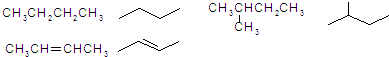题目内容
(1)在
Li
Li
Na
Mg
C
N中
① 和 互为同位素
② 和 质量数相等,但不能互称为同位素
③ 和 的中子数相等,但质子数不相等,所以不是同一种元素
(2)用电子式表示下列物质形成过程:氯化氢 氯化钠 .
6 3 |
7 3 |
23 11 |
24 12 |
14 6 |
14 7 |
①
②
③
(2)用电子式表示下列物质形成过程:氯化氢
考点:同位素及其应用,用电子式表示简单的离子化合物和共价化合物的形成
专题:化学用语专题,原子组成与结构专题
分析:(1)①
Li与
Li质子数相同,中子数不同,故互为同位素;
②
C 与
N的质量数都为14,但质子数不同,故不能互称为同位素;
③
Na的质子数为11,中子数为23-11=12;
Mg的质子数为12,中子数为24-12=12,故两者质子数不同,中子数相同;
(2)氯化氢为共价化合物,氢原子与氯原子通过共用电子对形成氯化氢分子;
氯化钠为离子化合物,钠离子与氯离子通过静电作用结合成化合物.
6 3 |
7 3 |
②
14 6 |
14 7 |
③
23 11 |
24 12 |
(2)氯化氢为共价化合物,氢原子与氯原子通过共用电子对形成氯化氢分子;
氯化钠为离子化合物,钠离子与氯离子通过静电作用结合成化合物.
解答:
解:(1)①
Li与
Li质子数相同,中子数不同,故互为同位素,故答案为:
Li;
Li;
②
C 与
N的质量数都为14,但质子数不同,故不能互称为同位素,故答案为:
C;
N;
③
Na的质子数为11,中子数为23-11=12;
Mg的质子数为12,中子数为24-12=12,故两者质子数不同,中子数相同,故答案为:
Na;
Mg;
(2)氯化氢为共价化合物,氢原子与氯原子通过共用电子对形成氯化氢分子,故用电子式表示的形成过程为: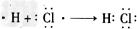 ;
;
氯化钠为离子化合物,钠离子与氯离子通过静电作用结合成化合物,故用电子式表示的形成过程为: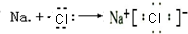 ,
,
故答案为: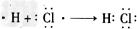 ;
;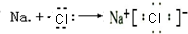 .
.
6 3 |
7 3 |
6 3 |
7 3 |
②
14 6 |
14 7 |
14 6 |
14 7 |
③
23 11 |
24 12 |
23 11 |
24 12 |
(2)氯化氢为共价化合物,氢原子与氯原子通过共用电子对形成氯化氢分子,故用电子式表示的形成过程为:
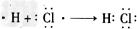 ;
;氯化钠为离子化合物,钠离子与氯离子通过静电作用结合成化合物,故用电子式表示的形成过程为:
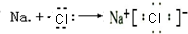 ,
,故答案为:
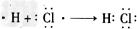 ;
;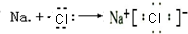 .
.
点评:本题考查同位素的概念、粒子间的数量关系、用电子式表示共价化合物和离子化合物的形成过程等,难度中等.

练习册系列答案
相关题目
分析如面的能量变化示意图,确定下列选项中正确的是( )
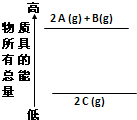

| A、2 A(g)+B(g)=2 C(g);△H<0 |
| B、2 A(g)+B(g)=2 C(g);△H>0 |
| C、2A+B=2 C;△H<0 |
| D、2C=2 A+B;△H<0 |
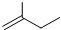
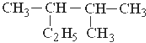 的名称是
的名称是