题目内容
某研究性学习小组在实验室中配制0.20mol?L-1的盐酸标准溶液,然后用其滴定某未知浓度的氢氧化钠溶液.
(1)配制待测液:将1.7g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所需的主要玻璃仪器除烧杯,200mL容量瓶,量筒,还有 ﹑ .
(2)滴定:
①盛装0.20mol?L-1盐酸标准液应该用 式滴定管,
②滴定时,先向锥型瓶中加酚酞作为指示剂;再逐滴滴定,观察到 时为滴定终点.
③有关数据记录如下:
数据处理:NaOH溶液的浓度为 mol?L-1,烧碱样品的纯度为 .(保留三位有效数字)
(3)试分析以下各项操作对实验结果的可能影响,用“偏高”﹑“偏低”或“无影响”等填空:
①若用蒸馏水冲洗锥形瓶,则会使测定的结果 ;
②读数时,若滴定前俯视读数,滴定后仰视读数,则会使测定结果 .
(1)配制待测液:将1.7g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所需的主要玻璃仪器除烧杯,200mL容量瓶,量筒,还有
(2)滴定:
①盛装0.20mol?L-1盐酸标准液应该用
②滴定时,先向锥型瓶中加酚酞作为指示剂;再逐滴滴定,观察到
③有关数据记录如下:
| 滴定序号 | 待测液体体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 起始读数 滴定前 | 终点读数 | ||
| 1 | 20.00 | O.50 | 20.40 |
| 2 | 20.00 | 6.OO | 26.10 |
| 3 | 20.00 | 4.OO | 24.00 |
(3)试分析以下各项操作对实验结果的可能影响,用“偏高”﹑“偏低”或“无影响”等填空:
①若用蒸馏水冲洗锥形瓶,则会使测定的结果
②读数时,若滴定前俯视读数,滴定后仰视读数,则会使测定结果
考点:配制一定物质的量浓度的溶液,中和滴定
专题:实验题
分析:(1)配制200mL一定物质的量浓度的氢氧化钠溶液需要仪器有:200mL容量瓶、胶头滴管、烧杯、玻璃棒、天平、药匙等;
(2)①酸性溶液应用酸式滴定管盛放;
②反应结束时溶液由红色变成无色;
③先分析数据的有效性,求出消耗盐酸的平均体积,然后根据关系式NaOH~HCl求出氢氧化钠的物质的量浓度,再计算烧碱样品的纯度;
(3)①用蒸馏水冲洗锥形瓶,不影响待测物的总物质的量;
②滴定前俯视,导致读数偏小;滴定后仰视,导致读数偏大,最终导致标准液盐酸体积偏大;
(2)①酸性溶液应用酸式滴定管盛放;
②反应结束时溶液由红色变成无色;
③先分析数据的有效性,求出消耗盐酸的平均体积,然后根据关系式NaOH~HCl求出氢氧化钠的物质的量浓度,再计算烧碱样品的纯度;
(3)①用蒸馏水冲洗锥形瓶,不影响待测物的总物质的量;
②滴定前俯视,导致读数偏小;滴定后仰视,导致读数偏大,最终导致标准液盐酸体积偏大;
解答:
解:(1)配制200mL一定物质的量浓度的氢氧化钠溶液需要仪器:200mL容量瓶、胶头滴管、烧杯、玻璃棒、天平、药匙,所需的主要玻璃仪器除烧杯,200mL容量瓶,量筒外,还需要玻璃棒和胶头滴管,
故答案为:玻璃棒、胶头滴管;
(2)①盛装0.20mol/L盐酸标准液应该使用酸式滴定管,故答案为:酸;
②到达滴定终点时溶液由红色变成无色且半分钟不褪色,
故答案为:由红色变成无色且半分钟不褪色;
③三次消耗盐酸体积分别为:20.40mL-0.50mL=19.90mL、26.10mL-6.00mL=20.10mL、24.00mL-4.00mL=20.00mL(舍去),
两三次消耗盐酸的平均体积为:20.00mL,
NaOH~~~HCl
1 1
n(NaOH) 0.2mol?L-1×0.020L
n(NaOH)=0.0040mol,故氢氧化钠的浓度为:
=0.20mol/L,
即20.00mL待测溶液含有m(烧碱)=n?M=0.0040mol×40g/mol=0.16g,
所以100mL待测溶液含有m(烧碱)=0.160g×
=0.80g,
烧碱的纯度ω(烧碱)=
×100%=94.1%,
故答案为:0.20mol/L;94.1%;
(3)①用蒸馏水冲洗锥形瓶,不影响待测物的总物质的量,滴定是不影响消耗的标准液的体积,
故答案为:无影响;
④滴定前俯视,导致读数偏小;滴定后仰视,导致读数偏大,最终导致消耗的标准液盐酸体积偏大,则测定结果偏高,
故答案为:偏高;
故答案为:玻璃棒、胶头滴管;
(2)①盛装0.20mol/L盐酸标准液应该使用酸式滴定管,故答案为:酸;
②到达滴定终点时溶液由红色变成无色且半分钟不褪色,
故答案为:由红色变成无色且半分钟不褪色;
③三次消耗盐酸体积分别为:20.40mL-0.50mL=19.90mL、26.10mL-6.00mL=20.10mL、24.00mL-4.00mL=20.00mL(舍去),
两三次消耗盐酸的平均体积为:20.00mL,
NaOH~~~HCl
1 1
n(NaOH) 0.2mol?L-1×0.020L
n(NaOH)=0.0040mol,故氢氧化钠的浓度为:
| 0.0040mol |
| 0.02L |
即20.00mL待测溶液含有m(烧碱)=n?M=0.0040mol×40g/mol=0.16g,
所以100mL待测溶液含有m(烧碱)=0.160g×
| 100 |
| 20 |
烧碱的纯度ω(烧碱)=
| 0.80g |
| 0.85g |
故答案为:0.20mol/L;94.1%;
(3)①用蒸馏水冲洗锥形瓶,不影响待测物的总物质的量,滴定是不影响消耗的标准液的体积,
故答案为:无影响;
④滴定前俯视,导致读数偏小;滴定后仰视,导致读数偏大,最终导致消耗的标准液盐酸体积偏大,则测定结果偏高,
故答案为:偏高;
点评:本题考查了滴定操作,操作时要规范,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、利用盖斯定律可计算某些难以直接测量的反应焓变 |
| B、如果一个化学方程式通过其他几个化学方程式相加减而得到,则该反应的焓变可由相关的化学方程式的焓变相加减而得到 |
| C、对于放热反应,放出的热量越多,焓变越小 |
| D、当同一个化学反应以不同的过程完成时,反应的焓变是不同的 |
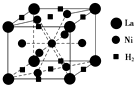 目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.
目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图. 的名称是
的名称是