题目内容
下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题:
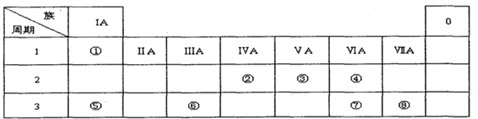
Ⅰ.(1)请画出元素⑧的阴离子结构示意图 .
(2)④、⑤、⑦的原子半径由小到大的顺序为 .
(3)⑤和⑥的最高价氧化物对应水化物的碱性强弱为 .
(4)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为 .
Ⅱ.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:
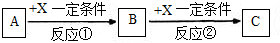
(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是 ;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式 .
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,写出A与C两溶液反应的离子方程式 .

Ⅰ.(1)请画出元素⑧的阴离子结构示意图
(2)④、⑤、⑦的原子半径由小到大的顺序为
(3)⑤和⑥的最高价氧化物对应水化物的碱性强弱为
(4)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为
Ⅱ.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:
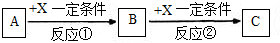
(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl.
Ⅰ.(1)Cl-离子核电荷数为17,核外有18个电子,有3个电子层,各层电子数为2、8、8;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)金属性越强,最高价氧化物对应水化物的碱性越强;
(4)④、⑤两种元素的原子按1:1组成的常见化合物为Na2O2,由钠离子与氯离子构成;
Ⅱ.(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,由转化关系可知,X为比较金属,则X为Fe,A为氯气、B为氯化铁、C为氯化亚铁;
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则A为铝盐,B为氢氧化铝、C为偏铝酸钠,X为氢氧化钠.
Ⅰ.(1)Cl-离子核电荷数为17,核外有18个电子,有3个电子层,各层电子数为2、8、8;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)金属性越强,最高价氧化物对应水化物的碱性越强;
(4)④、⑤两种元素的原子按1:1组成的常见化合物为Na2O2,由钠离子与氯离子构成;
Ⅱ.(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,由转化关系可知,X为比较金属,则X为Fe,A为氯气、B为氯化铁、C为氯化亚铁;
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则A为铝盐,B为氢氧化铝、C为偏铝酸钠,X为氢氧化钠.
解答:
解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl.
Ⅰ.(1)Cl-离子核电荷数为17,核外有18个电子,有3个电子层,各层电子数为2、8、8,离子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>S>O,故答案为:Na>S>O;
(3)金属性Na>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Al(HO)3,故答案为:NaOH>Al(HO)3;
(4)④、⑤两种元素的原子按1:1组成的常见化合物为Na2O2,由钠离子与氯离子构成,电子式为: ,
,
故答案为: ;
;
Ⅱ.(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,由转化关系可知,X为比较金属,则X为Fe,A为氯气、B为氯化铁、C为氯化亚铁,则:
C溶液中金属离子的方法是先加入KSCN溶液不显红色,再加入氯水显红色(或加入氢氧化钠溶液,产生白色沉淀,然后变成灰绿色,最后变成红褐色);
在酸性溶液中该金属离子能被双氧水氧化,该反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案为:先加入KSCN溶液不显红色,再加入氯水显红色(或加入氢氧化钠溶液,产生白色沉淀,然后变成灰绿色,最后变成红褐色);H2O2+2Fe2++2H+=2Fe3++2H2O;
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则A为铝盐,B为氢氧化铝、C为偏铝酸钠,X为氢氧化钠,A与C两溶液反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al(OH)3;Al3++3AlO2-+6H2O=4Al(OH)3↓.
Ⅰ.(1)Cl-离子核电荷数为17,核外有18个电子,有3个电子层,各层电子数为2、8、8,离子结构示意图为
 ,故答案为:
,故答案为: ;
;(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>S>O,故答案为:Na>S>O;
(3)金属性Na>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Al(HO)3,故答案为:NaOH>Al(HO)3;
(4)④、⑤两种元素的原子按1:1组成的常见化合物为Na2O2,由钠离子与氯离子构成,电子式为:
 ,
,故答案为:
 ;
;Ⅱ.(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,由转化关系可知,X为比较金属,则X为Fe,A为氯气、B为氯化铁、C为氯化亚铁,则:
C溶液中金属离子的方法是先加入KSCN溶液不显红色,再加入氯水显红色(或加入氢氧化钠溶液,产生白色沉淀,然后变成灰绿色,最后变成红褐色);
在酸性溶液中该金属离子能被双氧水氧化,该反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案为:先加入KSCN溶液不显红色,再加入氯水显红色(或加入氢氧化钠溶液,产生白色沉淀,然后变成灰绿色,最后变成红褐色);H2O2+2Fe2++2H+=2Fe3++2H2O;
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则A为铝盐,B为氢氧化铝、C为偏铝酸钠,X为氢氧化钠,A与C两溶液反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al(OH)3;Al3++3AlO2-+6H2O=4Al(OH)3↓.
点评:本题考查元素周期表与元素周期表、无机物推断,难度中等,需要学生具备扎实的基础.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
对下列事实的解释正确的是( )
| A、常温下,将铜放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中钝化 |
| B、浓硝酸在光照下变黄,证明硝酸不稳定,且产物有红棕色气体可溶于浓硝酸 |
| C、溴蒸气使湿润的碘化钾淀粉试纸变蓝,说明溴可与淀粉反应 |
| D、液氨是一种重要的制冷剂,说明氨气在液化时吸收大量的热 |
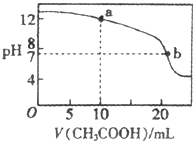 常温下有下列四种溶液:
常温下有下列四种溶液: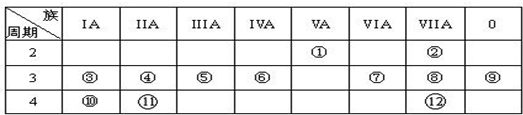
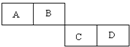 A、B、C、D四种短周期元素在周期表中的相对位置如图所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如图所示,A的单质与水蒸气反应可以制取水煤气.