题目内容
2.某烷烃蒸汽的密度是相同状况下氢气密度的36倍,则该烷烃可能的结构有3几种,其中有一种一氯取代物只有一种,写出这种同分异构体的结构简式: .
.
分析 相同条件下,密度之比等于相对分子质量之比,该烷烃蒸气蒸气的密度是H2的36倍,故该烷烃的相对分子质量为36×2=72,据此书写分子式;根据分子式写出符合条件的同分异构体的结构简式,其中有一种一氯取代物只有一种,则应只含一种H原子,以此解答该题.
解答 解:该烷烃蒸气蒸气的密度是H2的36倍,故该烷烃的相对分子质量为36×2=72,故该烃的分子式为C5H12;
其主链有5个碳原子的同分异构体有: ;其主链有4个碳原子的同分异构体有:
;其主链有4个碳原子的同分异构体有: ;其主链有3个碳原子的同分异构体有,
;其主链有3个碳原子的同分异构体有, ;其中有一种一氯取代物只有一种,应为
;其中有一种一氯取代物只有一种,应为 ,
,
故答案为:3; .
.
点评 本题主要考查有机物分子式的确定、同分异构体书写等,侧重于学生的分析能力的考查,难度不大,利用相对密度与C的质量分数进行推断是解题的关键.

练习册系列答案
相关题目
10.下列各组物质的性质顺序,不正确的是( )
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
17.已知:常温下浓度为0.1mol•L-1的下列溶液的pH如表:
下列有关说法正确的是( )
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1 mol•L-1Na2CO3溶液中至溶液中性,则溶液中2c (CO32ˉ)+c (HCO3ˉ)=0.1 mol•L-1 | |
| C. | 根据上表,水解方程式ClOˉ+H2O?HClO+OHˉ的水解常数K≈10ˉ7.6 | |
| D. | 向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-) |
7.根据题给信息,完成下列各小题:
Ⅰ、某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为c(Na+)=4×10-4mol/L,c(SO42-)=2.5×10-4mol/L,c(Cl-)=1.6×10-5 mol/L,c(NO3-)=1.4×10-5 mol/L,c(Ca2+)=1.5×10-5 mol/L,则该废水的pH为4.
Ⅱ、有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大;NaA溶液呈中性;1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,则这四种酸的酸性由强到弱的顺序为HA>HC>HB>HD.
Ⅲ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得
溶液的pH如下表:
请回答:
(1)从①组情况分析,HA是强酸还是弱酸弱酸(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
(3)②组情况表明,c大于0.2mol/L(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(4)从③组实验结果分析,说明HA的电离程度大于NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
Ⅰ、某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为c(Na+)=4×10-4mol/L,c(SO42-)=2.5×10-4mol/L,c(Cl-)=1.6×10-5 mol/L,c(NO3-)=1.4×10-5 mol/L,c(Ca2+)=1.5×10-5 mol/L,则该废水的pH为4.
Ⅱ、有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大;NaA溶液呈中性;1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,则这四种酸的酸性由强到弱的顺序为HA>HC>HB>HD.
Ⅲ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得
溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从①组情况分析,HA是强酸还是弱酸弱酸(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
(3)②组情况表明,c大于0.2mol/L(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(4)从③组实验结果分析,说明HA的电离程度大于NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
14.下列说法不正确的是( )
| A. | 化学反应可分为吸热反应和放热反应 | |
| B. | 化学反应的实质是旧键的断裂与新键的生成 | |
| C. | 化学反应中的能量变化都是以热能的形式表现出来 | |
| D. | 放热反应发生时不需加热 |
12.物质的量浓度相同的NaCl、MgCl2、AlCl3 三种溶液,当它们的体积比为1:2:1时,三种溶液中Cl-的物质的量之比为( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:4:3 |
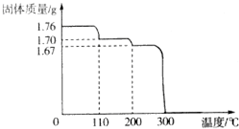 将1.76gHIO3固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示:
将1.76gHIO3固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示:
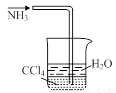
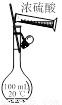
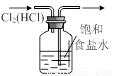
 某实验小组用如图所示装置探究SO2的性质.
某实验小组用如图所示装置探究SO2的性质.