题目内容
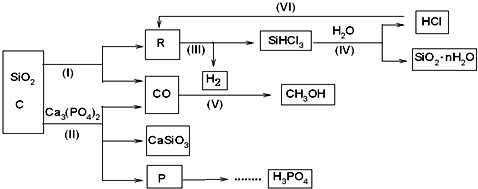
11.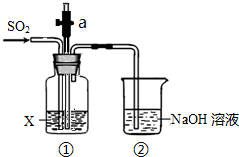 某实验小组用如图所示装置探究SO2的性质.
某实验小组用如图所示装置探究SO2的性质.请回答:
(1)装置②在实验中的作用是尾气吸收,防止污染空气.
(2)若X为品红溶液,可观察到装置①中溶液褪色,说明SO2具有漂白性.
(3)若X为紫色石蕊溶液,可观察到装置①中溶液变红,说明SO2的水溶液显a(填字母).
a.酸性 b.碱性
(4)若X为紫红色酸性高锰酸钾溶液(强氧化剂),可观察到装置①中溶液颜色变浅或褪色.你推测,SO2在该实验中表现还原性(填“氧化”或“还原”).
(5)若空气中排放的SO2超量,则引起的环境问题将会是酸雨 现象.
分析 (1)二氧化硫是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收;
(2)二氧化硫具有漂白性,可以使品红溶液褪色;
(3)二氧化硫通入紫色石蕊试液生成亚硫酸显示酸性;
(4)高锰酸钾溶液具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应;
(5)二氧化硫排放会形成酸雨污染环境;
解答 解:(1)二氧化硫是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收,装置②在实验中的作用是:尾气吸收,防止污染空气,
故答案为:尾气吸收,防止污染空气;
(2)二氧化硫具有漂白性,可以使品红溶液褪色,若X为品红溶液,可观察到装置①中溶液褪色,说明SO2具有漂白性,
故答案为:漂白性;
(3)二氧化硫通入紫色石蕊试液生成亚硫酸显示酸性,若X为紫色石蕊溶液,可观察到装置①中溶液变红,说明SO2的水溶液显酸性,选a,
故答案为:a;
(4)高锰酸钾溶液具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应,若X为紫红色酸性高锰酸钾溶液(强氧化剂),可观察到装置①中溶液颜色变浅或褪色.SO2在该实验中表现还原性,
故答案为:还原;
(5)二氧化硫排放会污染环境,若空气中排放的SO2超量,则引起的环境问题将会是形成酸雨,
故答案为:酸雨;
点评 本题考查了二氧化硫的性质实验验证、反应现象的判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
6.既与盐酸反应又能与氢氧化钠溶液反应的氧化物是( )
| A. | Al(OH)3 | B. | Al2O3 | C. | NaHCO3 | D. | Al |
16.常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )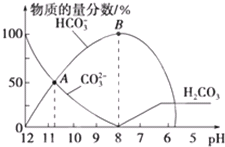

| A. | 当溶液的pH=7时,溶液的总体积为20mL(若忽略溶液混合后体积的变化) | |
| B. | 在0.1mol/L 的Na2CO3溶液中:c(Na+)+c(H+)═c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | 在A点所示的溶液中:c(CO32-)═c(HCO3-)>c(H+)>c(OH-) | |
| D. | 在B点所示的溶液中,浓度最大的阳离子是Na+ |
3.下列关子化学用语的表示正确的是( )
| A. | 质子数为94、中子数为144的钚(Pu)原子:14494Pu | |
| B. | H2O2的电子式: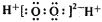 | |
| C. | S2-离子结构示意图: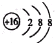 | |
| D. | 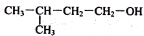 的名称2-甲基-4-丁醇 的名称2-甲基-4-丁醇 |
1.2001年1月,某地发生了导致四人死亡,一百多人中毒的食用熟牛肉中毒事件,经过对该牛肉的检测,发现某盐的含量比国家容许标准高800倍,该盐可能是( )
| A. | NaCl | B. | NaNO2 | C. | NaNO3 | D. | BaSO4 |
 .
.