题目内容
7.以淀粉为原料制取酒精,若有含400g淀粉的植物果实,经过反应制得227g 80%的酒精.则由植物果实中的淀粉制取酒精的转化率为多少?分析 先计算出制得乙醇的质量,然后根据关系式(C6H10O5)n~nC6H12O6 ~2nCH3CH2OH计算出已水解的淀粉的质量,进而计算由植物果实中的淀粉制取酒精的转化率.
解答 解:制得的227g 80%的酒精中含有乙醇的质量为:227g×80%=181.6g,设生成181.6g乙醇需要消耗淀粉的质量为m,
(C6H10O5)n~nC6H12O6 ~2nCH3CH2OH
162n 92n
m 181.6g
则162n:m=92n:181.6g,解得:m=319.8g,
所以由植物果实中的淀粉制取酒精的转化率为:$\frac{319.8g}{400g}$×100%=79.95%,
答:由植物果实中的淀粉制取酒精的转化率为79.95%.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握关系式法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列过程或现象与盐类水解无关的是( )
| A. | 纯碱溶液去油污 | B. | 明矾可作净水剂 | ||
| C. | 加热氯化铁溶液颜色变深 | D. | 硫酸氢钠溶液显酸性 |
18.A、B、C、D、E为原子序数依次增大的短周期主族元素,A与C、B与D分别同主族,且A、C元素的质子数之和是B、D元素质子数之和的一半.下列判断正确的是( )
| A. | 原子半径大小顺序:D>C>B>A | |
| B. | 由B和C元素组成的化合物,可以既含有离子键,又含有共价键 | |
| C. | 元素B、D、E分别与A形成的化合物中,熔沸点最低的是B与A形成的化合物 | |
| D. | 元素D与C形成的化合物在空气中长期放置不易变质 |
15.温度一定时,在密闭容器中发生可逆反应:mA(s)+nB(g)?pC(g),达到平衡后,若将混合气体的体积压缩到原来的$\frac{1}{2}$,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中正确的是( )
| A. | m+n<p | B. | C气体的体积分数增大 | ||
| C. | 平衡向正反应方向移动 | D. | B的转化率减小 |
9.下列装置图及有关说法正确的是( )


| A. | 装置①中K键闭合时,片刻后可观察到滤纸a点变红色 | |
| B. | 装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大 | |
| C. | 装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开 | |
| D. | 装置③中当铁制品上析出1.6 g铜时,电源负极输出的电子数为0.025 NA |
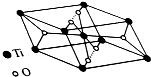 (1)下列说法正确的是AD(填序号)
(1)下列说法正确的是AD(填序号) ,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4的含有σ 键的数目为8NA.
,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4的含有σ 键的数目为8NA. 结合Na、Al、Fe的有关性质,回答下列问题.
结合Na、Al、Fe的有关性质,回答下列问题.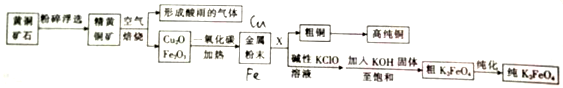
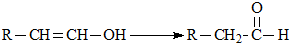 化学式为C9H10O2的有机物A有如下的转化关系
化学式为C9H10O2的有机物A有如下的转化关系
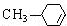 ,H:CH3COOCH=CH2
,H:CH3COOCH=CH2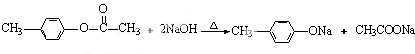
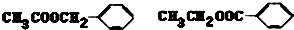 .
.