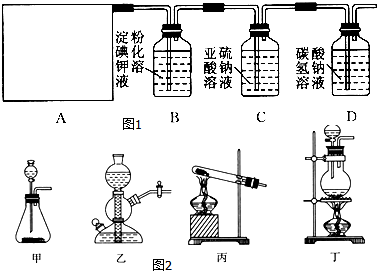
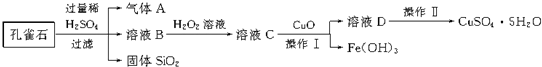
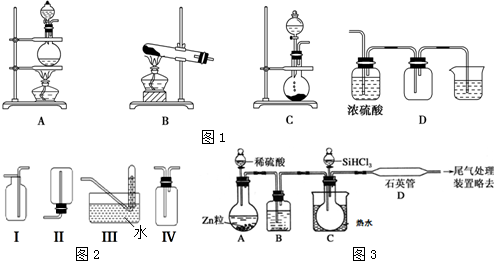
题目内容
2. (1)下列说法正确的是AD(填序号)
(1)下列说法正确的是AD(填序号)A.CH4与CO2分子式均为含有极性共价键的非极性分子
B.第一电离能:O>N>C.
C.沸点高低:CH4>SnH4>GeH4>SiH4
D.CH3+离子的空间构型为平面正三角形.
(2)CH4和CO2在Ni催化作用下反应可获得化工原料CO和H2
①Ni基态原子核外电子排布式为1S22S22P63S23P63d84s2
②与CO互为等电子体的阴离子的电子式为
 ,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4的含有σ 键的数目为8NA.
,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4的含有σ 键的数目为8NA.(3)CH4和CO2在含有钛氧化物的某种催化剂作用下,可直接转化为CH3COOH.
①CH3C00H中C原子轨道杂化类型为sp3和sp2
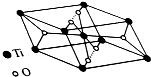
②钛氧化物晶胞结构如图所示,写出化学式TiO2.
分析 (1)A.由不同种元素的原子组成的共价键为极性键,空间构型为对称型的是非极性分子;
B.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;
C.不含有氢键的分子晶体,相对分子质量大的沸点高;
D.根据CH3+离子的价层电子对数以及杂化轨道类型判断CH3+离子的空间构型;
(2)①Ni是28号元素,其原子核外有28个电子,根据构造原理写出基态Ni原子核外电子排布式;
②原子个数相等、价电子数相等的微粒互为等电子体;该配合物的配离子中Ni原子和C原子、CO分子中C原子和O原子之间都存在σ键;
(3)①CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,根据杂化理论判断;②利用均摊法计算该晶胞中含有的原子个数,从而确定其化学式.
解答 解:(1)A.CH4分子中含有极性共价键C-H,空间构型为正四面体结构,为非极性分子,CO2 中C=O为极性键,二氧化碳为直线型,所以是非极性分子,故A正确;
B.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,故第一电离能顺序为:N>O>C,故B错误;
C.CH4、SnH4、GeH4、SiH4属于都不含有氢键的分子晶体,相对分子质量大的沸点高,所以沸点高低:SnH4>GeH4>SiH4>CH4,故C错误;
D.CH3+离子的价层电子对数=3+$\frac{4-1-1×3}{2}$=3,为sp2杂化,故D正确;
故答案为:AD;
(2)①Ni的原子序数为28,根据能量最低原理可写出电子排布式为1S22S22P63S23P63d84s2,
故答案为:1S22S22P63S23P63d84s2;
②CO分子中含有2个原子、价电子数是10,与CO互为等电子体的与CO互为等电子体的阴离子微粒有CN-或C22-,其电子式为 ,该配合物的配离子中Ni原子和C原子之间有4个σ键,CO分子中C和O之间存在1个σ键,1个π键,1个配位键,因此4个CO有4个σ键,故1mol Ni(CO)4中含有8molσ键即8NA,
,该配合物的配离子中Ni原子和C原子之间有4个σ键,CO分子中C和O之间存在1个σ键,1个π键,1个配位键,因此4个CO有4个σ键,故1mol Ni(CO)4中含有8molσ键即8NA,
故答案为: ;8NA;
;8NA;
(3)①CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,分别为sp3杂化、sp2杂化,
故答案为:sp3和sp2;
②该晶胞中氧原子个数为4×$\frac{1}{2}$+2=4,钛原子个数=8×$\frac{1}{8}$+1=2,所以化学式为TiO2,
故答案为:TiO2.
点评 本题考查化学键、电离能、离子的空间构型、晶胞计算、原子杂化方式判断、等电子体、原子核外电子排布等知识点,为高频考点,侧重考查学生知识运用能力及空间想象能力,易错点是价层电子对个数的计算方法,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
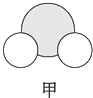 | 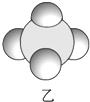 |  |
| 是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
(1)甲、乙、丙中含有的共同元素是氢(填名称).
(2)B元素在周期表中的位置为第2周期ⅣA族.
(3)上述元素的原子M层有一个未成对p电子的是Cl(填元素符号).
(4)丙的电子式为
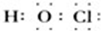 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl. | A. | 向0.1mol•L-1的氨水中加入同体积的水 | |
| B. | 向0.1mol•L-1的KOH溶液中加入同体积的水 | |
| C. | 向0.2mol•L-1的氨水中加入同体积的0.1mol•L-1盐酸 | |
| D. | 向0.2mol•L-1的KOH溶液中加入同体积的0.1mol•L-1盐酸 |
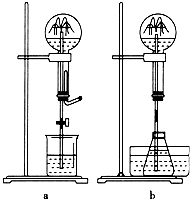 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.