题目内容
6.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 1mol苯分子中含有C═C键的数目为3NA | |
| B. | 含1molNa2CO3的溶液中,阴离子总数大于NA | |
| C. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 标准状况下,22.4L空气中含有的氧原子数为2NA |
分析 A.苯分子中不含碳碳双键;
B.碳酸钠为强碱弱酸盐,水溶液中部分碳酸根离子水解生成碳酸氢根离子和氢氧根离子;
C.亚铁离子和碘离子都能够被氯气氧化,1mol碘化亚铁完全反应消耗1.5mol氯气;
D.空气中氧气、二氧化碳、水蒸气都含有氧原子.
解答 解:A.苯分子中不含碳碳双键,故A错误;
B.碳酸钠为强碱弱酸盐,水溶液中部分碳酸根离子水解,含有1mol碳酸钠溶液中,因为碳酸根离子水解,阴离子总数大于NA,故B正确;
C.1molFeI2中含有1mol亚铁离子、2mol碘离子,完全反应需要消耗1.5mol氯气,转移了3mol电子,转移的电子数为3NA,故C错误;
D.空气中氧气、二氧化碳、水蒸气都含有氧原子,各种气体含量未知,无法计算氧原子个数,故D错误;
故选:B.
点评 本题考查了学生对物质的量、粒子数、质量、体积等与阿伏伽德罗常数关系的理解,掌握公式的使用和物质的结构是解题关键,注意苯分子结构特点、盐类水解规律,题目难度中等.

练习册系列答案
相关题目
7.在标准状况下,与48g氧气所含的原子数目相同的是( )
| A. | 8g CH4 | B. | 22.4L H2O | C. | 17g NH3 | D. | 67.2L He |
17.构成下列四种物质的微粒间,既存在离子键又存在共价键的是( )
| A. | CH3CH2ONa | B. | K2S | C. | MgCl2 | D. | SO3 |
14.某温度下,BaSO4与水组成的混合物中,存在如下过程:BaSO4(s)?Ba2+(aq)+SO42-(aq),向其中加入少量Na2SO4固体,下列说法错误的是( )
| A. | BaSO4溶解的量减小 | B. | BaSO4的电离程度减小 | ||
| C. | 溶液的导电能力增大 | D. | c (Ba2+)与c (SO42-)的乘积增大 |
1.表为元素周期表的一部分,用化学符号回答下列问题.
(1)元素②的单质的结构式N≡N 元素⑧的+1价含氧酸的结构式H-O-Cl.
(2)元素①的最高价氧化物的电子式 ,元素③和⑤形成原子个数比为1:1的化合物的电子式
,元素③和⑤形成原子个数比为1:1的化合物的电子式 ,元素②、④的气态氢化物反应后的产物的电子式
,元素②、④的气态氢化物反应后的产物的电子式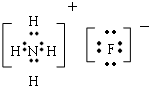 .
.
(3)用电子式表示元素④和⑨形成化合物的过程 .
.
(4)元素③、④、⑥、⑦对应的气态氢化物中,稳定性最弱的是PH3(填化学式)
(5)元素④、⑤、⑦、⑨形成的简单离子中,半径最大的离子的离子结构示意图 ;
;
(6)元素⑥、⑦、⑩对应的最高价氧化物的水化物中,酸性最强的是H2SO4(填化学式),250mL 1mol/L的该溶液与足量的稀氨水反应放出的热量为Q1kJ,该反应的热化学方程式为:H2SO4(aq)+2NH3•H2O(aq)=(NH4)2SO4(aq)+2H2O(l)△H=-4Q1kJ/mol,元素⑤、⑧的最高价氧化物的水化物的稀溶液反应生成1mol水时放出Q2kJ的热量,则NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H=(Q2-2Q1)kJ/mol.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 第二周期 | ① | ② | ③ | ④ | |||
| 第三周期 | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 第四周期 | ⑨ | ⑩ |
(2)元素①的最高价氧化物的电子式
 ,元素③和⑤形成原子个数比为1:1的化合物的电子式
,元素③和⑤形成原子个数比为1:1的化合物的电子式 ,元素②、④的气态氢化物反应后的产物的电子式
,元素②、④的气态氢化物反应后的产物的电子式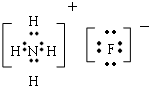 .
.(3)用电子式表示元素④和⑨形成化合物的过程
 .
.(4)元素③、④、⑥、⑦对应的气态氢化物中,稳定性最弱的是PH3(填化学式)
(5)元素④、⑤、⑦、⑨形成的简单离子中,半径最大的离子的离子结构示意图
 ;
;(6)元素⑥、⑦、⑩对应的最高价氧化物的水化物中,酸性最强的是H2SO4(填化学式),250mL 1mol/L的该溶液与足量的稀氨水反应放出的热量为Q1kJ,该反应的热化学方程式为:H2SO4(aq)+2NH3•H2O(aq)=(NH4)2SO4(aq)+2H2O(l)△H=-4Q1kJ/mol,元素⑤、⑧的最高价氧化物的水化物的稀溶液反应生成1mol水时放出Q2kJ的热量,则NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H=(Q2-2Q1)kJ/mol.
11.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
18.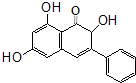 高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
 高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )| A. | 高良姜素的分子式为C15H15O5 | |
| B. | 高良姜素分子中含有3个羟基、8个双键 | |
| C. | 高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应 | |
| D. | 1mol高良姜素与足量的钠反应生成33.6LH2 |
15.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl和NaOH的物质的量之比为( )
| A. | 3:1 | B. | 1:1 | C. | 2:1 | D. | 1:3 |